时间:2017-03-05 13:28:17
1、选择题 在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2的化合物是
[? ]
A.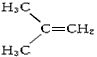
B.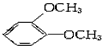
C.
D.
2、选择题 在同温同压下,决定气体体积大小的因素是
A.气体的种类
B.分子间的平均距离
C.分子本身的大小
D.气体的分子数
3、选择题 下列说法不正确的是
A.配一定物质的量浓度溶液实验中,容量瓶用蒸馏水洗净后即可使用,不需要干燥和润洗
B.“硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触
C.变色硅胶干燥剂含有CoCl2,干燥剂呈蓝色时,表示不具有吸水干燥功能
D.除去干燥CO2中混有的少量SO2,可将混合气体通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
4、填空题
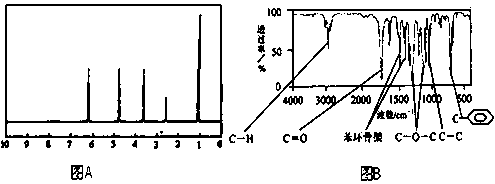
5、选择题 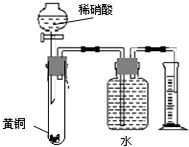 下列对有关实验的描述不正确的是
下列对有关实验的描述不正确的是
A.在浓氨水中加入生石灰可以制取少量的NH3
B.用水就可以一次性鉴别溴苯、苯、乙酸三种物质
C.用如右图所示的装置可以测定黄铜(Cu、Zn合金)中Zn的含量
D.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质可以是H2O、Ba(OH)2、Na2CO3、HCl