时间:2017-03-05 13:23:59
1、填空题 某同学帮助水质检测站配制1000mL 1 mol·L-1NaOH溶液以备使用。
(1)该同学应选择___________mL的容量瓶。
(2)其操作步骤如下图所示,则如图操作应在下图中的?(填选项字母)之间。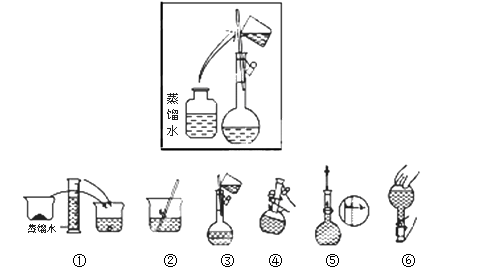
A.②与③ ? B.①与② ? ? C.④与⑤
(3)该同学应用托盘天平称取NaOH固体?g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项?(填选项字母)。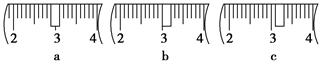
(4)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视读数,浓度会?;
②转移溶液过程中,少量液体溅出来,浓度会?;
③容量瓶未干燥,浓度会?;
④定容摇匀后发现溶液凹面低于刻度线,浓度会?。
(5)配制溶液的实际操作过程中,动作要快,否则由于?,会使配制的NaOH溶液的浓度比1 mol·L-1?(填“大”或“小”)。
参考答案:(1)1000;
(2)C;
(3)40.0;? c;
(4)①偏大?②偏小?③无影响?④无影响
(5)NaOH易潮解、易吸收空气中的CO2而变质(答出一点即可);?小 ;
本题解析:(1)配制1000mL溶液只能使用1000mL容量瓶;(2)图中为往容量瓶中加水,距离刻线1~2厘米时改用胶头滴管,所以加在⑤之前;(3)根据公式:m=M·n? n=C·V可得m=40.0g,称量时游码位置为3.1,选C;(4)①定容时,俯视读数,水没有加到刻线,浓度会偏大;②转移溶液过程中,少量液体溅出来,溶质损失一部分,浓度会偏低;③容量瓶未干燥,最后要加水,没有影响;④定容摇匀后发现溶液凹面低于刻度线,有部分溶液留在瓶塞和瓶壁,没有影响,不能再加水,否则浓度会减小。(5)配制溶液的实际操作过程中,动作要快,否则称量时氢氧化钠潮解而导致称量不够而浓度减小。
本题难度:一般
2、选择题 设NA为阿伏加德罗常数,下列叙述中,正确的是
A.标准状况下,NH3和CH4的混合气体2.24L,所含电子总数为2NA
B.7g CnH2n中含氢原子数为NA
C.78 g 过氧化钠与CO2反应,转移电子数为2NA
D.25℃时,0.1mol/L的NaOH溶液中,含有钠离子数为0.1NA
参考答案:B
本题解析:A、NH3分子、CH4分子都含10个电子,标准状况下, 2.24L NH3和CH4的混合气体物质的量为0.1mol,则所含电子总数为NA,故A错误;B、7g CnH2n中含氢原子物质的量=7g÷14ng/mol×2n=1mol,则氢原子数为NA,则B正确;C、CO2与Na2O2反应的对应关系为:Na2O2~e?,78 g 过氧化钠物质的量为1mol,则转移电子的物质的量为1mol,数目为NA,故C错误;D、没有给出溶液的体积,无法求算离子数目,故D错误。
考点:本题考查阿伏加德罗常数的计算。
本题难度:一般
3、填空题 “84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶某品牌“84消毒液”,
并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25%? NaClO、1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L-1。
(2)该同学取100 mL该品牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+?)≈________mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是________。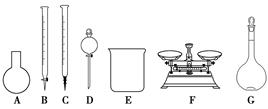
A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
参考答案:(1)4.0 (2)0.04 (3)C
本题解析:(1)根据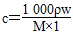 ,
,
c(NaClO)=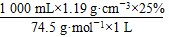
≈4.0 mol·L-1。
(2)4.0 mol·L-1的NaClO溶液稀释100倍后,其浓度为0.04 mol/L,即c(Na+)=0.04 mol/L。
(3)选项A,需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A,B、C、D不需要,但还需玻璃棒和胶头滴管;选项B,配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用;选项C,由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低;选项D,应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol·L-1×74.5 g·mol-1=149 g。
本题难度:一般
4、选择题 下列溶液中Cl-浓度与50mL?1mol?L-1?AlCl3溶液中Cl-的物质的量浓度不相等的是( )
A.150mL 1mol?L-1的NaCl溶液
B.75mL 3mol?L-1NH4Cl溶液
C.150mL 3mol?L-1的KCl溶液
D.75mL 1mol?L-1的FeCl3溶液
参考答案:A.150mL1mol?L-1的NaCl溶液中Cl-的物质的量浓度1mol/L,不相等,故A选;
B.75mL3mol?L-1NH4Cl溶液中Cl-的物质的量浓度3mol/L,相等,故B不选;
C.150mL3mol?L-1的KCl溶液中Cl-的物质的量浓度3mol/L,相等,故C不选;
D.75mL1mol?L-1的FeCl3溶液Cl-的物质的量浓度1mol/L×3=3mol/L,相等,故D不选;
故选A.
本题解析:
本题难度:简单
5、填空题 将质量比为15:7的NO和N2混合,则混合气体中NO和N2的物质的量之比为______;氧原子和氮原子的个数之比为______;22g该混合气体在标准状况下的体积为______L.
参考答案:质量比为15:7的NO和N2混合,则混合气体中NO和N2的物质的量之比为1530:728=2:1;
混合气体中n(O)=n(NO),n(N)=n(NO)+2n(N2),原子个数之比等于物质的量之比,故氧原子和氮原子的个数之比为2:(2+1×2)=1:2;
22g该混合气体中NO的质量为22g×1515+7=15g,NO的物质的量为15g30g/mol=0.5mol,N2的质量为22g-15g=7g,物质的量为7g28g/mol=0.25mol,故混合气体的体积为:(0.5mol+0.25mol)×22.4L/mol=16.8g,
故答案为:2:1;1:2;16.8.
本题解析:
本题难度:简单