时间:2017-03-05 13:19:21
1、选择题 下列各项实验的基本操作中,正确的是?
A.为了加快过滤速度,可用玻璃棒搅拌过滤器中液体
B.为了防止容量瓶漏液,可在玻璃塞涂凡士林
C.为了使制取氢气的速度加快,可向稀硫酸中加入少量硫酸铜溶液
D.为了使配制的FeCl3溶液不产生浑浊,可加入盐酸和铁片
参考答案:C
本题解析:A.在过滤器中用玻璃棒搅拌容易损坏滤纸,从而导致实验失败;B.容量瓶是用来配制标准溶液的,在玻璃塞上涂凡士林会使溶液受到污染;C.可以,因加入CuSO4后,会有Zn+CuSO4=Cu+ZnSO4反应发生,这样在溶液中会形成无数微小的铜锌原电池,从而使反应速度加快;D.加入铁片,会将FeCl3还原,生成FeCl2,从而导致溶液不纯。
本题难度:一般
2、选择题 下列实验操作中有错误的是(? )
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.实验室制取蒸馏水的装置中,温度计水银球应与蒸馏烧瓶的支管口在同一水平线
C.用淘洗的方法从沙里淘金
D.用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干
参考答案:D
本题解析:NaCl的溶解度受温度的变化不大,故采用蒸发溶剂的方法得到固体,但是蒸发至有较多量的固体析出时即停止加热,D错误;分液时,上层液体从上口倒出,防止污染,A正确;制取蒸馏水时,温度计是要测量蒸气的温度,故与蒸馏烧瓶的支管口在同一水平线上,B正确;由于金子的密度比沙大,淘洗过程中,在水的冲击下,泥沙被冲走了,剩下的金子则留在容器中,C正确。
点评:对化学实验的考查是历年的高考重点,考生在备考中应注意对化学实验、化学仪器的相关知识的积累。
本题难度:简单
3、选择题 下列实验操作中,正确的是?
A.配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解
B.蒸馏操作时,应将温度计插入烧瓶中的溶液中
C.测溶液的pH时,将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
D.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
参考答案:A
本题解析:蒸馏操作时,应将温度计插入烧瓶的支管出口处,B不正确。C不正确,应该用玻璃棒蘸取待测液点在试纸上。分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体从上口倒出,D不正确,因此正确的答案选A。
本题难度:简单
4、选择题 要配制浓度约为2 mol/L NaOH溶液100 mL,下面的操作正确的是 (?)
A.用托盘天平称取8 g NaOH固体(NaOH固体放置于天平的托盘上),放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8 g NaOH固体,放入100 mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL
C.称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,在不断搅拌下慢慢倒入烧杯中
参考答案:D
本题解析:溶质在烧杯中溶解,不能在量筒和容量瓶中溶解,B、C项错误;溶液为100ml,溶解时加水要小于100ml,A项错;若用5 mol/L NaOH溶液配制需要40ml,D项正确。
本题难度:一般
5、选择题 下列有关化学实验操作正确的是?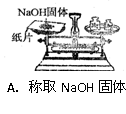
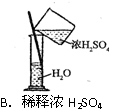
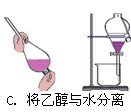
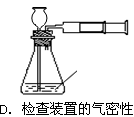
参考答案:D
本题解析:略
本题难度:简单