时间:2017-03-03 01:14:13
1、选择题 某溶液中只含有K+、Fe3+、Cl-、SO42-四种离子,其中K+、Fe3+、Cl-三种离子的个数比为5:2:3,则溶液中Fe3+与SO42-的个数比为
[? ]
A.1:2
B.1:3
C.2:3
D.3:5
参考答案:A
本题解析:
本题难度:简单
2、实验题 (13分)实验室欲配制250mL 0.2 mol·L-1的碳酸钠溶液,回答下列问题:
可供选择的仪器:①量筒②胶头滴管③托盘天平④药匙⑤烧瓶⑥烧杯
(1)通过计算可知,应用托盘天平称取?g碳酸钠晶体(Na2CO3?10H2O)。
(2)配制过程需要的仪器_____________(填序号),还缺少的仪器有?。
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)_____________;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.用托盘天平准确称取所需的Na2CO3?10H2O晶体的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作______________;若定容时俯视刻度线_______________。
参考答案:(1) 14.3?(2)①②③④⑥;? 250mL容量瓶,玻璃棒
(3)BCAFED?(4)偏低;偏高
本题解析:(1)配制250mL 0.2 mol·L-1的碳酸钠溶液需要n(Na2CO3)=0.05mol,所以需要称取Na2CO3?10H2O 14.3g。
(2)配置过程中需要的仪器有量筒,胶头滴管,托盘天平,药匙,烧杯,250mL容量瓶。
(3)配置的过程为计算、称量、溶解、冷却转移、洗涤、定容、摇匀,装瓶贴签。
(4)根据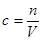 如果没有洗涤,则溶质的物质的量比正常值低,所以配制的浓度偏低,如果定容时俯视刻度,溶液的体积比正常值小,所以配制的浓度偏高。
如果没有洗涤,则溶质的物质的量比正常值低,所以配制的浓度偏低,如果定容时俯视刻度,溶液的体积比正常值小,所以配制的浓度偏高。
点评:这类习题是专项考查一定物质的量浓度的习题,难度较低,比较基础。
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值,下列说法正确的是
A.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
B.53gNa2CO3固体含有的CO32-离子数为0.5 NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的共价键数目为3NA
D.5.6 g Fe和一定量的浓HNO3或稀HNO3完全反应,转移电子一定均为0.3NA
参考答案:B
本题解析:A、没有说明气体状况,故不一定为1mol;
C、乙烯有6个共价键,丁烯有12个,为两倍,摩尔质量也为2倍,故可以只算乙烯,0.75mol,共价键为4.5mol;
D、铁可能为+2或+3价,故不能确定。
本题难度:一般
4、选择题 用NA表示阿伏德罗常数,下列叙述正确的是
A.标准状况下,22.4 L H2O含有的分子数为NA
B.常温常压下,1.06 g Na2CO3含有的Na+离子数为0.01NA
C.通常状况下, NA个CO2分子占有的体积为22.4 L
D.常温常压下,48gO2和O3的混合气体中含有的氧原子数为3NA
参考答案:D
本题解析:标准状况下, H2O是液体,无法计算物质的量,A错,1.06 g Na2CO3的物质的量n=m/M=1.06g÷106 g/mol=0.01 mol,Na+的物质的量为0.2 mol,个数为0.02NA,B错;CO2是气体,要在标准状况下计算体积,C错;D中O2和O3均由O构成,故48g混合气体中含有的氧原子的物质的量为48g÷16g/mol=3mol,氧原子数为3NA,正确,选D。
考点:有关物质的量和阿伏伽德罗常数的计算。
本题难度:一般
5、实验题 某同学用NaOH固体配制250 mL 2 mol/L的NaOH溶液,并进行有关实验。请回答下列问题:
(1)需要称取NaOH固体__________g。
(2)配制该NaOH溶液时使用的仪器除托盘天平(砝码、镊子)、药匙、量筒、250mL容量瓶、胶头滴管外,还必须用到的仪器有________________等。
(3)取所配制的NaOH溶液100 mL,与一定质量的铝充分反应,铝全部溶解后,生成的气体在标 准状况下的体积为3.36 L,则参加反应的铝的质量为__________g,设反应后溶液的体积仍为100 mL,则反应后溶液中OH-的物质的量浓度为__________。
参考答案:(1)20.0
(2)烧杯,玻璃棒
(3)2.7;1 mol/L
本题解析:
本题难度:一般