时间:2017-03-03 01:10:18
1、填空题 Ⅰ.已知下列金属晶体:Na、Po、K、Fe、Cu、Mg、Zn、Au。其堆积方式为:
(1)简单立方堆积的是____________________________________________;
(2)钾型的是______________________________________________________;
(3)镁型的是______________________________________________________;
(4)铜型的是_____________________________________________________。
Ⅱ.A、B、C、D都是短周期元素,原子半径D>C>A>B,已知:A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。
试回答:
(1)这四种元素分别是:A______,B______,C______,D______(填元素名称)。
(2)这四种元素单质的熔点由高到低的顺序是________(填元素名称)。
(3)C的固态氧化物是________晶体,D的固态单质是________晶体。
(4)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式_______________________________________________________________。
参考答案:Ⅰ.(1)Po
(2)Na、K、Fe
(3)Mg Zn
(4)Au、Cu
Ⅱ.(1)碳 氧 硅 钠
(2)碳>硅>钠>氧
(3)原子 金属
(4)Na2CO3+SiO2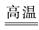 Na2SiO3+CO2↑
Na2SiO3+CO2↑
本题解析:Ⅱ.(1)当D原子最外层有1个电子时,则C原子最外层有4个电子(ⅣA
族),因为A与C为同一主族,且原子半径C>A,则短周期中C为Si,A为
C;当D原子最外层有2个电子时,则C原子最外层有8个电子(0族),据题
意知不可能。根据D的原子半径(最大)、最外层电子数(1个)、短周期可判断
D为Na。由质子数关系可判断B为O。
本题难度:一般
2、选择题 下列说法中正确的是
[? ]
A.金刚石晶体中的最小环由6个碳原子构成
B.Na2O2晶体中阴离子与阳离子数目之比为1:1
C.1mol SiO2晶体中含2mol Si-O键
D.金刚石化学性质稳定,即使在高温下也不会和O2反应
参考答案:A
本题解析:
本题难度:简单
3、填空题 现有①NaCl?②干冰?③冰?④Na2O2?⑤白磷?⑥硫磺?⑦MgCl2?⑧金刚石?⑨NH4NO3?⑩SiO2十种物质,按下列要求回答:
(1)以上物质中属于原子晶体的是?。
(2)既有离子键又有共价键的是?。
(3)熔化时不需要破坏化学键的是?。
参考答案:(6分,每空2分)
(1)⑧⑩?(2)④⑨?(3)②③⑤⑥
本题解析:根据构成晶体的微粒判断。
(1)以上物质中属于原子晶体的是金刚石、SiO2。
(2)既有离子键又有共价键的是Na2O2、NH4NO3。
(3)熔化时不需要破坏化学键的是干冰、冰、白磷、硫磺。
点评:对于定义型题的做法是:紧扣定义即可.本题考查了学生对概念的区分、总结能力。
本题难度:一般
4、选择题 下列分子中,键角最大的是
[? ]
A. H2S
B. H2O
C. CCl4
D. NH3
参考答案:C
本题解析:
本题难度:简单
5、选择题 氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是(?)
A.AlON和石英的化学键类型相同
B.AlON和石英晶体类型相同
C.AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同
D.AlON和(工业上通过电解法制备铝用的)Al2O3晶体类型相同
参考答案:D
本题解析:A、氮氧化铝和石英都是原子晶体,化学键类型相同,正确;B、二者都是原子晶体,正确;C、氮氧化铝含有共价键而氧化铝含有离子键,化学键的类型不同,正确;D、氧化铝是离子晶体,二者类型不同,错误。
本题难度:一般