时间:2017-03-03 01:08:21
1、简答题 某活动课程小组拟用50mL?NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25mL?NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式______.此方案第一步的实验装置如下图所示:
(2)加入反应物前,如何检验整个装置的气密性:______
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是______,作用是______
(4)在实验室通常制法中,装置A还可作为下列______(填序号)气体的发生装置.
①HCl ②H2 ③Cl2 ④NH3
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为______?mol/L.
参考答案:(1)碳酸氢钠能和氢氧化钠反应生成碳酸钠和水,反应离子方程式为HCO3-+OH-═CO32-+H2O.
故答案为:HCO3-+OH-═CO32-+H2O.
(2)用止水夹夹住B、与烧杯之间的乳胶管,然后从漏斗中注入一定量的水,在装置内密封气体,使漏斗中的水面高于锥形瓶内的水面,过一会,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气.
故答案为:用止水夹夹住B、与烧杯之间的乳胶管,然后从漏斗中注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,过一段时间,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气.
(3)盐酸易挥发,制取的二氧化碳含有HCl,B中盛放饱和碳酸氢钠溶液,吸收HCl气体,同时生成二氧化碳.
故答案为:饱和碳酸氢钠溶液;吸收HCl气体.
(4)该制取装置适合不加热制取气体,HCl、Cl2、NH3的制备都需要加热,不能使用该装置制备,制取H2不需要加热,可以选用该装置.
故答案为:②.
(5)m(NaOH)=50mL×1.44g/mL×40%=28.8g,所以n(NaOH)=28.8g40g/mol=0.72mol,根据钠元素守恒可知,溶液中n(Na2CO3)=12n(NaOH)=0.36mol,故c(Na2CO3)=0.36mol0.05L=7.2?mol/L.
故答案为:7.2?mol/L.
本题解析:
本题难度:一般
2、实验题 过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用,它与二氧化碳反应的化学方程式为:2Na2O2+2CO2 = 2Na2CO3+O2。某学生为了验证这一性质,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出如图所示实验装置: 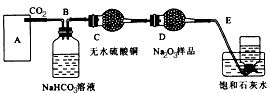
(1)A中制取CO2的装置,应从下列图①、②、③中选哪个图:_____。 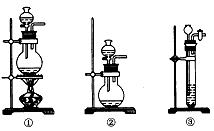
B装置的作用是___________,C装置内可能出现的现象是___________。为了检验E中收集到的气体,在取出集气瓶后,用____的木条伸入集气瓶内,木条会出现________________。
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因:___________________。
(3)若D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?_________________。
(4)反应完毕时,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值___________(填“大”或 “小”),这是由于______________。
(5)你认为上述A~E的实验装置中,E部分是否安全、合理?E是否需要改为下列四项中的哪一项:_______________(用甲、乙、丙、丁回答)。 
参考答案:(1)图②;吸收A装置中产生的酸雾;变蓝;带火星的木条;复燃
(2)D中有部分CO2未参加反应流入E中生成CaCO3沉淀
(3)E中石灰水的白色浑浊明显增加,瓶内液面的下降接近停止
(4)小;因样品中含有不与CO2反应生成气体的杂质(如Na2CO3)
(5)乙
本题解析:
本题难度:一般
3、实验题 已知单质硫是淡黄色固体粉末,难溶于水。实验室制氯气的反应原理为:MnO2+4HCl(浓) ?MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:?
?MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:? 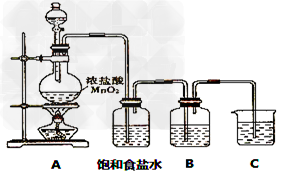
(1)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-还原性强;④HCl比H2S稳定;⑤硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可作为氯元素比硫元素非金属性强的依据的是______________?。
A.②④?B.②③④⑤?C.②④⑤?D.全部
(2)装有饱和食盐水的洗气瓶的作用是?______________
(3)装置B中盛放的试剂是______________(填选项),实验现象为____________?。
A.Na2S溶液?B.Na2SO3溶液?C.Na2SO4溶液
(4)装置B中的溶液在实验后质量增重了0.78g,则在B中反应的气体为___________mol
(5)装置C中盛放烧碱稀溶液,目的是吸收剩余气体,防止污染空气。写出反应的离子方程式:____________________。
参考答案:(1)B
(2)为了除去气体中的HCl
(3)A ;生成淡黄色沉淀或溶液变浑浊
(4)0.02
(5)Cl2?+2OH-=Cl+ClO-+H2O
本题解析:
本题难度:一般
4、选择题 下列装置或操 作能达到实验目的的是
作能达到实验目的的是
A.验证反应的热效应
B.定量测定化学反应速率
C.滴定FeSO4溶液
D.构成铜锌原电池
参考答案:A
本题解析:略
本题难度:一般
5、选择题 下列有关实验操作错误的是( )
A.从碘水中提取碘可用萃取的方法
B.分离含Mg2+和Al3+的混合液,可加入过量NaOH溶液,然后过滤
C.NH4+的检验:加入NaOH溶液微热,再用湿润的蓝色石蕊试纸检验变红
D.用KSCN溶液可检验Fe3+离子
参考答案:A、从碘水中提取碘可以用本或是四氯化碳做萃取剂来进行萃取的方法,故A正确;
B、铝离子可以和过量的强碱反应生成偏铝酸盐可溶性的溶液,但是镁离子只会生成沉淀,然后过滤,即可以将含Mg2+和Al3+的混合液分离,故B正确;
C、铵盐可以和强碱反应生成具有刺激性气味的氨气,则NH4+的检验时先加入NaOH溶液微热,再用湿润的红色石蕊试纸检验变蓝,故C错误;
D、三价铁离子遇到硫氰酸根离子显示红色,可以用硫氰酸钾来检验铁离子,故D正确.
故选C.
本题解析:
本题难度:一般