时间:2017-03-03 00:42:10
1、计算题 (6分)把2.56g纯铜放入盛有一定量浓硝酸的大试管中,立即发生反应,当铜反应完毕后,共生成1.12L气体(标况),计算反应中耗用硝酸的物质的量是多少?(要求写出计算过程)
参考答案:0.13mol
本题解析:n(Cu)=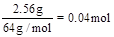 ,则溶液中的n(NO3-)=2n(Cu)=0.08mol。反应完毕后共生成1.12L气体,无论气体是NO还是NO2,消耗硝酸的量都为
,则溶液中的n(NO3-)=2n(Cu)=0.08mol。反应完毕后共生成1.12L气体,无论气体是NO还是NO2,消耗硝酸的量都为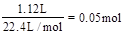 。根据原子守恒可知,反应中消耗硝酸的总量为0.05mol+0.08mol=1.3mol。
。根据原子守恒可知,反应中消耗硝酸的总量为0.05mol+0.08mol=1.3mol。
点评:硝酸与金属反应,硝酸在反应过程中一部分做氧化剂,变成气体,一部分起酸的作用,以NO3-的形式存在溶液中。
本题难度:一般
2、选择题 体积为VmL,密度为dg/mL,溶质的摩尔质量为Mg·mol-1,物质的量浓度为cmol·L-1,溶质的质量分数为a%,溶质的质量为mg。下列式子正确的是( ? )
A.m=aV/100d
B.c=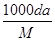
C.c=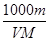
D.a%=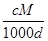 %
%
参考答案:C
本题解析:A.溶液的质量为ρV,溶质的质量等于溶液的质量与质量分数的乘积,则m="ρV×a%=" Vρa/100,故A错误;
B.根据c=1000ρa%/M,可知,c=10ρa/M,故B错误;
C.根据c=n/V可知,c="(m/M)/(" V×10-3) ="1000m/" VM,故C正确;
D.质量分数等于溶质质量与溶液质量的比,则a%=" cVM×100%/1000ρV=" CM%/10ρ,故D错误。
故选C。
点评:本题考查物质的量浓度的有关计算,明确质量、物质的量、质量分数与物质的量浓度之间的关系及计算公式即可解答,难度不大。
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氮原子的氮气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64gSO2中含有的原子数小于3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.1 mo1 Na2O2与足量H2O反应,转移了2 NA个电子
参考答案:A
本题解析:A、含有NA个氮原子的氮气物质的量为0.5mol,所以在标准状况下的体积约为11.2L,故A正确;B、64gSO2物质的量为:64g÷64g/mol=1mol,则含有的原子数为3NA,故B错误;C、常温常压下,气体摩尔体积不是22.4L/mol,所以11.2L Cl2含有的分子数不是0.5NA,故C错误;D、Na2O2与H2O反应电子转移为:Na2O2~ e?,所以1 mo1 Na2O2与足量H2O反应,转移了 NA个电子,故D错误。
考点:本题考查阿伏加德罗常数的计算。
本题难度:一般
4、选择题 下列叙述中正确的是
[? ]
参考答案:B
本题解析:
本题难度:简单
5、填空题 氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)=2NH3(g) △H=
参考答案:
本题解析:
本题难度:困难