时间:2017-03-03 00:41:11
1、填空题 已知A、B、C、D、E、F、G为前四周期七种元素且原子序数依次增大,其中A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C原子核外成对电子数比未成对电子数多1个,其氢化物常用作致冷剂,D原子未成对电子与周期数相同,在E元素所在周期中的基态该原子的第一电离能最小;F原子价电子nsn-lnpn+l;G单质是硬度最大的金属。
请回答下列问题:
(1)G元素基态原子价电子排布式为?。
(2)B、C、D三种元素的最简单氢化物的键角由小到大的顺序为____?(填元素符号),常温下硬度最大的B单质、E2F、H2D及H2F的沸点由大到小的顺序为____?(填化学式)
(3)D元素与氟元素相比,电负性:D?氟元素(填“>”、“=”或“<”),?下列表述中能证明这一事实的是?(填选项序号)-
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)离子化合物CA5的晶体中含有多种化学键:但一定不含有的化学键是?(填选项序号)。
A.极性键?B.非极性键?C.配位键?D.金属键
(5)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为____?;1molB2A4分子中含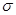 键?mol。
键?mol。
(6)如图是E的氯化物的晶胞示意图,最近两个E离子之间距离为a cm,则该晶体密度为?(已知阿伏加德罗常数为NA).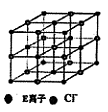
?
参考答案:(1)3d54s1
(2)O、N、C? C、Na2S 、H2O、 H2S
(3)<? B、C
(4)B、D
(5)sp2杂化 ;? 5
(6)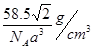
本题解析:根据题意可推出这几种元素分别是:A是H;B是C;C是N;D是O;E是Na;F是S;G 是Cr。(1)Cr元素基态原子价电子排布式为 3d54s1?。2)甲烷的键角为109°28′;NH3的键角为键角为107°18′;H2O的键角为104.3°。所以它们键角由小到大的顺序为O、N、C。常温下硬度最大的C单质金刚石属于原子晶体;Na2S属于离子晶体;H2O及H2S都属于分子晶体。一般情况下沸点的高低顺序是:原子晶体>离子晶体>分子晶体。由于在H2O之间存在氢键,增加了分子之间的相互作用,所以沸点H2O>H2S。故沸点由大到小的顺序为C> Na2S > H2O > H2S 。(3)元素的非金属性越强,其电负性就越大。由于非金属性F>O。所以电负性F>O。(4)离子化合物NH5可表示为NH4H.在其晶体中含有的化学键包括离子键、极性共价键、配位键。不含有非极性键和金属键。因此选项为B、D。(5)在C2H4中C原子轨道的杂化类型为sp2杂化。1mol C2H4分子中含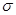 键有4和C—H键和一个C—C键共5个。(6)在每个晶胞中含有的Na+个数为:8×1/8+6×1/2=4;含有的Cl-的个数为:12×1/4+1=4。即每个晶胞中含有4个NaCl。最近两个Na+在面对角线的位置的一半,设晶胞的边长为L.其离子之间距离为a cm。
键有4和C—H键和一个C—C键共5个。(6)在每个晶胞中含有的Na+个数为:8×1/8+6×1/2=4;含有的Cl-的个数为:12×1/4+1=4。即每个晶胞中含有4个NaCl。最近两个Na+在面对角线的位置的一半,设晶胞的边长为L.其离子之间距离为a cm。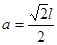 。所以
。所以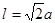 。该晶体密度为
。该晶体密度为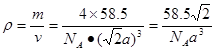 g/cm3.
g/cm3.
本题难度:困难
2、选择题 Cs是第IA族元素,F是第ⅦA族元素,估计Cs和F形成的化合物可能是
[? ]
A.室温为气体
B.化学式为CsF2
C.室温为固体
D.离子化合物
参考答案:CD
本题解析:
本题难度:简单
3、选择题 A元素原子的核电荷数为11,B元素原子的质子数为8,A和B化合形成化合物Z,下列说法中错误的是( )
A.A形成+1价阳离子
B.Z一定与水反应
C.Z一定是M2O型离子化合物
D.Z的熔点较高
参考答案:C
本题解析:
本题难度:一般
4、选择题 以下说法正确的是
[? ]
A.共价化合物内部可能有极性键和非极性键
B.原子或离子间相互的吸引力叫化学键
C.非金属元素间只能形成共价键
D.金属元素与非金属元素的原子间只形成离子键
参考答案:A
本题解析:
本题难度:简单
5、选择题 元素X、Y、Z原子序数之和为36,X、Y在同一周期,X2+与Z2-具有相同的核外电子层结构.下列推测正确的是( )
A.同族元素中Z的氢化物稳定性最高
B.原子半径X>Y,离子半径X2+>Z2-
C.同主族元素中X的金属性最弱
D.同周期元素中Y的最高价含氧酸的酸性最强
参考答案:X2+与Z2-具有相同的核外电子层结构,则X为第ⅡA族元素,Z为第ⅥA族元素,且在周期表中,X在Z元素的下一周期,元素X、Y、Z原子序数之和为36,X、Y在同一周期,则X、Y不可能处于第四周期,第四周期二者原子序数之和最小为19+20=39,则X、Y处于第三周期、Z处于第二周期,故X为Mg、Z为O;又因为X、Y、Z原子序数之和为36,则Y的原子序数=36-8-12=16,故Y为S,
A.Z为O元素,同主族自上而下非金属性减弱,故O元素非金属性最强,故水的稳定性最强,故A正确;
B.Mg2+、O2-电子层结构相同,核电荷数越大离子半径越小,故离子半径Mg2+<O2-,故B错误;
C.同周期自左而右金属性减弱,故第三周期中Na的金属性最强,Mg次之,故C错误;
D.同周期自左而右非金属性增强,非金属性越强最高价含氧酸的酸性越强,故HClO4的酸性最强,故D错误;
故选A.
本题解析:
本题难度:简单