时间:2017-03-03 00:31:00
1、简答题 某研究性学习小组,用浓硝酸、3mo/L稀硝酸、蒸馏水、氢氧化钠溶液及二氧化碳等药品,按下图装置进行试验(夹持仪器已略去),探究浓、稀硝酸氧化性的相对强弱.实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,由此得出的结论是浓硝酸的氧化性强于稀硝酸.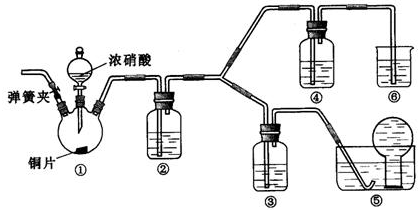
(1)装置①中发生反应的化学方程式是______.
(2)装置②的药品是水,则发生反应的化学方程式是______.
(3)装置③中盛放3mo/L稀硝酸、装置④中盛放浓硝酸,则装置④的液面上面可观察到______;装置⑥中盛放氢氧化钠溶液,其作用是______.
(4)检验装置的气密性后,加入药品.在装置①滴加 91Exam.org浓硝酸之前,需打开弹簧夹,通入CO2一段时间,再关闭弹簧夹,该操作目的是______.
(5)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体.同学们分别设计了以下3个试验来判断两种看法是否正确.这些方案中可行的是______(选填序号字母)
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化.
参考答案:(1)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O,反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)二氧化氮与水反应生成硝酸与NO,反应方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(3)进入装置④的气体为NO,浓硝酸能将NO氧化成NO2,装置④液面的上方会产生红棕色气体,
由装置④出来的尾气中含有NO、NO2,NO、NO2都是有毒气体,直接排放为污染空气,故装置⑥中盛放氢氧化钠溶液吸收NO、NO2,防止污染大气,
故答案为:液面的上方会产生红棕色气体;吸收尾气中的NO、NO2,防止污染大气;
(4)由于装置中残存的空气,能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,
故答案为:赶净装置中的空气,使整个装置充满CO2,防止装置②中反应生成的NO被空气氧化;
(5)要证明是Cu(NO3)2浓度过高或是溶解了NO2导致装置①中溶液呈绿色,一是可设计将溶解的NO2赶走或向硝酸铜溶液中通入二氧化氮,再观察颜色变化,二是降低溶液中Cu(NO3)2溶液的浓度,观察颜色变化,
a.加热可以降低NO2溶解度,通过观察颜色变化可以判断,故a正确;
b.加水稀释,硝酸铜难度降低,二氧化氮反应,无法判断,故b错误;
c.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,增大溶液中NO2浓度,通过观察颜色变化可以判断,故c正确;
故选ac.
本题解析:
本题难度:一般
2、选择题 一定量的浓硝酸与足量的铜完全反应后,生成的气体中含有( )
A.NO
B.NO2
C.H2
D.无法确定
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列反应中硝酸既能表现出酸性又能表现出氧化性的是
A.使石蕊试液变红
B.与铜反应放出NO气体生成Cu(NO3)2和H2O
C.与Na2CO3反应放出CO2气体生成NaNO3和H2O
D.与S单质混合共热时生成H2SO4和NO2、H2O
参考答案:B
本题解析:能与其他物质反应生成盐和水,这种物质就具有酸性;能使指示剂显酸色,也能说明这种物质具有酸性.反应中能使其他物质的化合价升高,自身中某元素化合价降低,这种物质就表现出氧化性.
本题难度:一般
4、简答题 实验室里常利用铜与稀硝酸反应来制取NO,当有19.2gCu参加反应时,请完成下列问题:
(1)写出反应方程式并计算能生成多少升NO(标准状况下)?
(2)计算被还原的HNO3的物质的质量?
参考答案:(1)铜与稀硝酸反应发生3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,n(Cu)=19.2g64g/mol=0.3mol,
由方程式可知0.3molCu参加反应,生成0.2molNO,则V(NO)=0.2mol×22.4L/mol=4.48L,
答:反应的方程式为3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,能生成4.48升NO;
(2)0.3molCu参加反应,消耗0.8mol硝酸,其中0.6mol硝酸表现为酸性,有0.2mol表现为氧化性,被还原,质量为0.2mol×63g/mol=12.6g,
答:被还原的HNO3的物质的质量为12.6g.
本题解析:
本题难度:一般
5、填空题 金属(M)的腐蚀是因为发生反应:M-ne-→Mn+。金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
(1)一种钢铁防腐的方法是将钢铁放在冷的浓硝酸中浸泡。但是加热或在稀HNO3中,铁与硝酸会不断反应。不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图。钢铁在冷的浓硝酸中浸泡能防腐的原因是__________________。 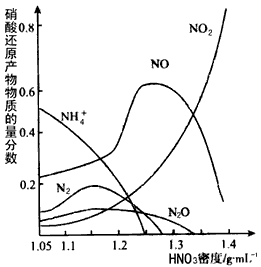
(2)工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是_________________。
(3)由图示可知,密度等于1. 35 g/mL的硝酸与铁反应时,其还原产物主要是_____________;足量的铁与一定量的浓硝酸反应时,反应过程中可能的气体产物有________;还原产物中NH4+的物质的量分数随
_______而增大;请用一句话概括该图反映出的基本结论:_______________。
(4)mmol铁与极大量的密度为1.35 g/mL的硝酸溶液完全反应放出nL气体(体积在标准状况下测定),此时溶液中Fe元素的存在方式是___________,n的值最接近_____(填字母编号)。
A.22. 4m B.33. 6m C.44. 8m D.67. 2m
参考答案:(1)铁在冷的浓硝酸中会“钝化”,在钢铁表面形成一层致密氧化物保护膜
(2)硝酸易挥发,且不稳定,见光易分解,故不易操作,生成物对环境污染严重
(3)NO2、NO;NO2、NO、N2、N2O;硝酸密度的减少;硝酸的浓度越大,其还原产物中氮元素化合价越高(或硝酸浓度越低,还原产物中氮元素化合价越低)
(4)Fe3+;B
本题解析:
本题难度:一般