时间:2017-03-03 00:17:53
1、实验题 以下是有关SO2、Cl2的性质实验。 
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。 若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?____________- (填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为_____________ 。
(2)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式________________ 。
(3)将0.23 mol SO2和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应,在一定温度下,反应达到平衡,得到0.12 mol SO3.则反应的平衡常数K =_____________ 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度_____________ 。(填“填大”、“不变”或“减小”),氧气的转化率 _____________(填“升高”、“不变”或“降低”)。
参考答案:(1) 相同;2SO2 + O2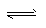 2SO3?
2SO3?
(2) 4Cl2 + S2O32-+ 5H2O == 2SO42-+ 8Cl-+ 10H+
(3)K=23.8 mol/L?; 减小?; 降低
本题解析:
本题难度:一般
2、选择题 下列实验原理、装置、试剂选用、结论正确的是
A.用湿润的pH试纸测定稀盐酸的pH
B.用下图1构成锌—铜原电池
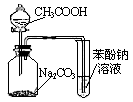
C.用下图2根据有关实验现象推知酸性:CH3COOH>H2CO3>C6H5OH
D.用下图3验证溴乙烷发生消去反应生成烯烃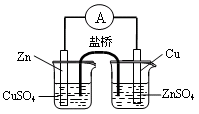
 ?
?
图1?图2?图3
参考答案:C
本题解析:A 错误,检测溶液的PH值时,pH试纸不能润湿
B 错误,左右两个烧杯的溶液颠倒一下。
C 正确,强酸制弱酸
D 错误,挥发出的乙醇蒸气也能是高锰酸钾褪色。
本题难度:一般
3、实验题 请设计CO2在高温下与木炭反应生成CO的实验。
?(1)在下面方框中,A表示由长颈漏斗和锥形瓶组成的气体发生器,请在A后完成该反应的实验装置示意图(夹持装置、连接胶管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、 C……;其他可选用的仪器(数量不限)简易表示如下: 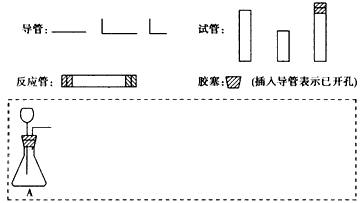
(2)根据方框中的装置图,填写下表 
(3)有人对气体发生器作如下改进:在锥形瓶中放人一小试管,将长颈漏斗下端插入小试管中。改进后的优点是_________________________________________________;
(4)验证CO的方法是_____________________________________________。
参考答案:(1)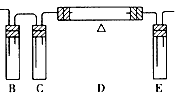
(2)
(3)可以通过控制加酸的量,来控制气体产生的快慢,同时小试管中充满盐酸,可以起到液封作用,防止反应激烈时气体经漏斗冲出
(4)点燃气体,火焰呈蓝色,再用一个内壁附着有澄清石灰水的烧杯罩在火焰上,烧杯内壁的石灰水变浑浊
本题解析:
本题难度:一般
4、实验题 某实验小组用下列装置进行乙醇催化氧化的实验.
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:
①?;
②?.
(2)甲和乙两个水浴作用不相同.其中甲的作用是?;
(3)进行一段时间后,若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中含有________.(填名称)
参考答案:(1)①2Cu + O2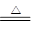 2CuO(2分) ②CH3CH2OH + CuO
2CuO(2分) ②CH3CH2OH + CuO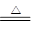 CH3CHO + Cu + H2O(2分)
CH3CHO + Cu + H2O(2分)
(2)使乙醇气化进入下一装置与氧气反应。(1分)?(3)乙酸(1分)
本题解析:(1)在加热的条件下,铜被氧化生成氧化铜,氧化铜能把乙醇氧化生成乙醛,而氧化铜又被还原生成铜,反应的化学方程式是2Cu + O2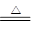 2CuO、CH3CH2OH + CuO
2CuO、CH3CH2OH + CuO CH3CHO + Cu + H2O。
CH3CHO + Cu + H2O。
(2)由于在反应中需要乙醇蒸汽,所以甲中水浴的作用是使乙醇气化进入下一装置与氧气反应。
(3)试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,这说明有酸性物质生成,所以生成的液体中含有乙酸。
点评:该题以乙醇的催化氧化为载体,重点考查学生的综合实验能力,有利于调动学生的学习兴趣,激发学生的学习积极性。该题的关键是明确实验原理,然后结合题意和装置图灵活运用即可,有利于调动学生的学习兴趣和学习积极性。
本题难度:一般
5、简答题 如图实验装置用于验证某些物质的性质.在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片.试回答下列问题:
(1)在A试管内发生反应的化学方程式是______.
(2)B装置的作用是______.
(3)在双球干燥管内发生反应的化学方程式为______.
(4)双球干燥管内观察到的实验现象是______;上述实验现象说明:______.
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是:______.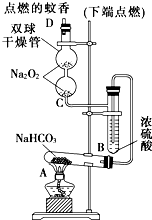
参考答案:(1)依据装置分析判断是加热碳酸氢钠固体的反应生成碳酸钠和二氧化碳水;
反应的化学方程式为:2NaHCO3?△?.?Na2CO3+H2O+CO2↑;故答案为:2NaHCO3?△?.?Na2CO3+H2O+CO2↑;
(2)B中盛的是浓硫酸起到吸收水蒸气干燥二氧化碳气体;故答案为:吸收气体中的水蒸气(干燥CO2)
(3)过氧化钠和二氧化碳反应生成碳酸钠和氧气;反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2;
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(4)过氧化钠是淡黄色固体,随反应进行变为白色固体碳酸钠,反应生成氧气具有助燃性,蚊香燃烧更剧烈;
故答案为:淡黄色的Na2O2逐渐转变为白色粉末,点燃的蚊香燃烧更加剧烈;
(5)氧化钠和二氧化碳反应生成碳酸钠,无氧气生成,在二氧化碳环境,蚊香逐渐熄灭;
故答案为:点燃的蚊香逐渐熄灭;
本题解析:
本题难度:一般