时间:2017-03-03 00:13:56
1、填空题 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应反应来制备甲醇.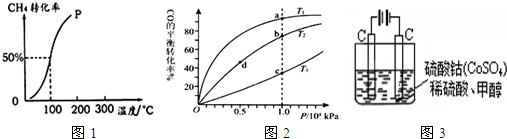
反应I:CH4?(g)+H2O?(g)=CO?(g)+3H2?(g)△H=+206.0kJ?mol-1
反应II:CO?(g)+2H2?(g)=CH3OH?(g)△H=-129.0kJ?mol-1
(1)CH3OH?(g)和H2(g)反应生成CH4(g)与H2O(g)的热化学方程式为______.
(2)将1.0mol?CH4和2.0mol?H2O?(?g?)通入容积固定为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为______.
②100℃时反应I的平衡常数为______.
③可用来判断该反应达到平衡状态的标志有______.(填字母)
A.CO的含量保持不变?
B.容器中CH4浓度与CO浓度相等
C.容器中混合气体的密度保持不变?
D.3V正(CH4)=V逆(H2)
(3)按照反应II来生成甲醇,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是______
A.温度:T1>T2>T3
B.正反应速率:ν(a)>ν(c);?ν(b)>ν(d)
C.平衡常数:K(a)>K(c);?K(b)=K(d)
D.平均摩尔质量:M(a)<M(c);?M(b)>M(d)
(4)工业上利用甲醇制备氢气的常用方法之一为:甲醇蒸汽重整法.该法中的一个主要反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是______.
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图3装置模拟上述过程:
①写出阳极电极反应式______.
②写出除去甲醇的离子方程式______.
③若3图装置中的电源为甲醇-空气-KOH溶液的燃料电池,则电池负极的电极反应式为:______.
2、填空题 已知:
①将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s) +O2(g)=CO2(g) △H=-393.5 kJ/mol
CO(g) +l/2O2(g)=CO2(g) △H= -283.0 kJ/mol
H2(g) +l/2O2(g)=H2O(g) △H= -242.0 kJ/mol
请回答:
(1)根据以上信息,写出C(s)与水蒸气反应的热化学方程式:________________________。
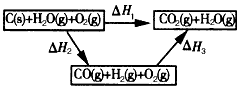
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的 热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图所示的循环图,并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
(3)
3、选择题 2008年9月我国“神七”发射升空,中国航天员实现首次太空行走.运载火箭的原料用肼(N2H4)作为发动机的燃料,NO2为氧化剂,反应生成氮气和水蒸气.已知:
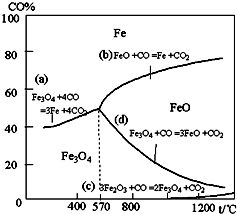
4、填空题 钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如图:
(1)铁在元素周期表中位于______周期______族.
(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:______(选用右图中的a、b、c、d填空).
(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是______.
(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温
(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:
| 反应序号 | 化学反应 | 反应热 ① Fe2O3(s)+3CO(g)=2Fe(s)+3CO?2(g) △H1=-26.7kJ?mol-1 ② 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=-50.8kJ?mol-1 ③ Fe3O4(s)+CO(g)=3FeO(s)+CO2?(g) △H3=-36.5kJ?mol-1 ④ FeO(s)+CO(g)=Fe(s)+CO2(g) △H4 |
5、填空题 参考下列图表和有关要求回答问题。
(1)甲图是l mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是____,△H的变化是____ (填“增大”“减小”或“不变”)。请写出
NO2和CO反应的热化学方程式:____________________; 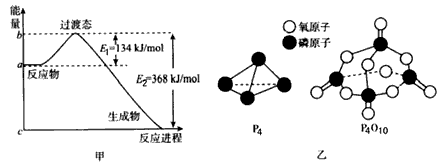
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.O kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)△H=-192.9 kJ/mol
又知③H2O(g)=H2O(l) △H=-44 kJ/mol
则甲醇的燃烧热化学方程式为____________________;
(3)下表是部分化学键的键能数据
已知白磷的燃烧热为d kJ/mol,白磷及其完全燃烧的产物结构如乙图所示,则上表中x=________kJ/mol(用含有a、b、c、d的代数式表示)