时间:2017-03-03 00:13:36
1、选择题 有pH均为2的盐酸、硫酸、醋酸三瓶溶液,下列说法正确的是
[? ]
A.设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是:c1>c2>c3
B.取同体积的三种酸分别加蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是V1=V2=V3
C.完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是V2 =V1 >V3
D.取同体积的酸的溶液分别加入足量的锌粉,反应刚开始放出H2的速率依次为v1、v2、v3, 则其关系是v2 > v1 >v3
参考答案:C
本题解析:
本题难度:一般
2、选择题 已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )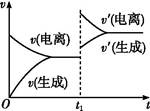
A.加少量烧碱溶液
B.升高温度
C.加少量冰醋酸
D.加水
参考答案:B
本题解析:由图改变条件后,v(电离)>v(生成),知平衡向电离方向移动,且在拐点处(即改变条件的瞬间),v(电离)和v(生成)都增大,符合该条件的只有B。
本题难度:一般
3、选择题 相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是
[? ]
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列溶液中导电性最强的是(?)
A. 醋酸
醋酸
B. 溶液
溶液
C.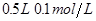 盐酸
盐酸
D.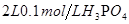 溶液
溶液
参考答案:B
本题解析:溶液的导电性强弱与溶液中阴阳离子的浓度大小和离子所带的电荷数有关系,溶液中氢离子最大的是硫酸中氢离子的浓度,所以选项B正确。
本题难度:简单
5、选择题 已知醋酸达到电离平衡后,改变某条件使电离平衡向正反应方向移动了,则下列说法正确的是( )
A.醋酸的电离程度一定增大
B.发生电离的分子总数增多
C.溶液的pH一定减小
D.溶液的导电能力一定变强
参考答案:A、因改变某条件使电离平衡向正反应方向移动,由HAc?H++Ac-,若加无水醋酸,则电离平衡正向移动时电离程度减小,故A错误;
B、电离平衡正向移动,醋酸电离度增大,即发生电离的分子总数增多,故B正确;
C、因升高温度或加水都能使电离平衡正向移动,若为加水,电离程度增大,生成氢离子的物质的量增大,但氢离子的浓度减小,pH增大,故C错误;
D、升高温度或加水都能使电离平衡向正反应方向,若改变的条件为加水,则电离程度增大,但离子的浓度变小,溶液的导电性变弱,故D错误;
故选B.
本题解析:
本题难度:一般