时间:2017-03-03 00:06:41
1、填空题 某地有软锰矿和闪锌矿两座矿山,它们的组成如下:
软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%,其余为水分;
闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。 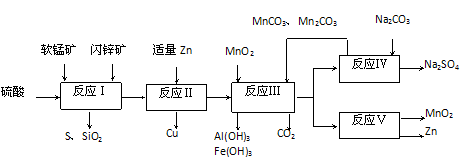
请回答下列问题:
(1)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。试完成反应I中生成CuSO4
和MnSO4的化学方程式:MnO2+CuS+____=_____↓+_______+CuSO4+________
(2)反应Ⅱ加入适量锌的作用是___________;如果锌过量,还会进一步发生反应的离子方程式为______________________。
(3)反应III要调节pH生成Fe(OH)3、Al(OH)3,中和过量的H+所使用的物质是___________,调节的pH范围是___________(pH数据见下表)。 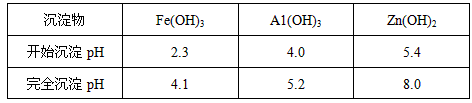
(4)本工艺可以循环利用的物质除有MnCO3、ZnCO3以外,还有___________。
参考答案:(1)2H2SO4;S↓;MnSO4;2H2O
(2)将溶液中的硫酸铜转化为铜;Zn + Fe2+=Fe+Zn2+或Zn+Mn2+=Mn+Zn2+
(3)MnCO3、ZnCO3;5.2~5.4
(4)Zn、MnO2
本题解析:
本题难度:一般
2、填空题 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图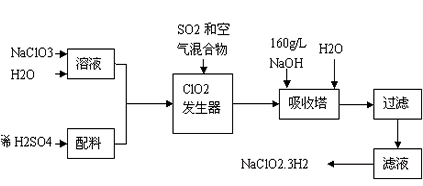
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)发生器中鼓入空气的作用可能是_________________。
(2)吸收塔内发生反应的化学方程式为________________________。
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是___________________。
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是________________________
参考答案:(1)稀释ClO2以防止爆炸
(2)2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2
(3)连续测定吸收塔内溶液的pH
(4)蒸发、冷却结晶、过滤
本题解析:
本题难度:一般
3、填空题 亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程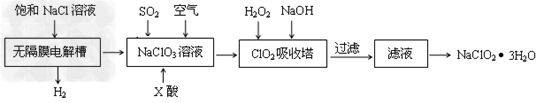
已知:
①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体只能保持在稀释状态下以防止爆炸性分解,且需现合成现用。
③ClO2气体在中性和碱性溶液中不能稳定存在。 ?
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式:____________________。
(2)反应生成ClO2气体需要X酸酸化的原因为:________X酸为_________。
(3)吸收塔内的温度不能过高的原因为:____________________________
(4)吸收塔内ClO2随着还原剂的不同和溶液酸碱性的变化可被还原为ClO2-或Cl-。ClO2被S2-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。请写出pH≤2时ClO2与S2-反应的离子方程式: 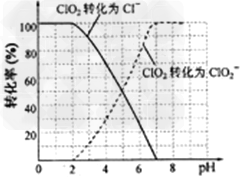
(5)第二步向NaClO3溶液中通SO2的同时通入空气的原因为:____________________。
(6)从滤液中得到NaClO2·3H2O粗晶体的操作步骤为_______?、_______、________。
参考答案:(1)Cl-+6e-+6OH-==ClO3-+3H2O
(2)ClO2只能在酸性环境中存在;硫酸
(3)防止H2O2分解
(4)2ClO2+5S2-+?8H+?==2Cl-+5S↓+4H2O?
(5)稀释ClO2气体,防止爆炸
(6)蒸发浓缩、冷却结晶、过滤
本题解析:
本题难度:一般
4、填空题 以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
ⅴ.煅烧FeCO3,得到Fe2O3固体。已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是______________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_________________。
(3)Ⅲ中,生成FeCO3的离子方程式是_______________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________________。
(4)IV中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42-的操作是____________________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 2Fe2O3+4CO2。现煅烧464.0 kg 的FeCO3,得到
2Fe2O3+4CO2。现煅烧464.0 kg 的FeCO3,得到
316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________Kg。(摩尔质量/g·mol-1:
FeCO3 116 Fe2O3 160 FeO 72)
参考答案:(1)Fe+2Fe3+=3Fe2+
(2)加入硫酸,H+浓度增大,使Fe2++2H2O Fe(OH)2+2H+得平衡向逆反应方向移动,从而抑制
Fe(OH)2+2H+得平衡向逆反应方向移动,从而抑制
FeSO4的水解
(3)Fe2++2HCO3-==FeCO3↓+CO2↑+H2O;4FeCO3+6H2O+O2==4Fe(OH)3↓+4CO2↑
(4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
(5)288.0
本题解析:
本题难度:一般
5、填空题 铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应.如:2Al+Fe2O3
? |
参考答案:(1)反应的特点为一种单质和一种化合物反应生成另一种单质和另一种化合物,应为置换反应,
故答案为:置换反应;
(2)反应为置换反应,应为活泼金属置换出较不活泼金属,故答案为:比铝不活泼的;
(3)铝粉与MnO2在高温下反应生成Mn和Al2O3,反应的方程式为4Al+3MnO2?高温?.?3Mn+2Al2O3,
故答案为:4Al+3MnO2?高温?.?3Mn+2Al2O3.
本题解析:
本题难度:简单