时间:2017-03-03 00:06:41
1、选择题 下列氧化物不能跟铝粉组成铝热剂的是( )
A.W03
B.MgO
C.MnO2
D.V205
参考答案:B
本题解析:
本题难度:简单
2、填空题 (三选一)【化学与技术】
2011年8月12日,网上传云南曲靖市越州镇有总量5000余吨的重毒化工废料铬渣由于非法丢放,毒水被直接排放南盘江中。
Ⅰ:某工厂对制革工业污泥中Cr(III)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+) 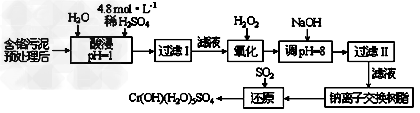
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表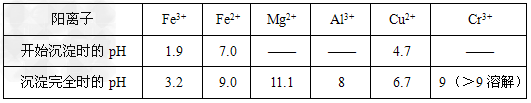
(1)实验室用18.4?mol/L的浓硫酸配制250?mL?4.8?mol/L的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需____________。 ?
(2)酸浸时,为了提高浸取率可采取的措施是______________(至少答一点)。?
(3)加入H2O2的作用是__________________________,调节溶液的pH=8是为了除去_________离子。 ?
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的的杂质离子是____________。
(5)还原过程发生以下反应(请配平):? _____Na2Cr2O7+_____SO2+____?________?=?____?Cr(OH)(H2O)5SO4+_______Na2SO4;
Ⅱ:工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(6)阳极的电极反应式为_______________。在阴极附近溶液pH升高的原因是(用电极反应方程式解释)__________。
参考答案:(1)250mL容量瓶、胶头滴管
(2)①升高反应温度,②搅拌,③过滤后再向滤渣中加入硫酸(多次浸取),④适当延长浸取时间(只要答出任意一点即可)
(3)氧化+3价Cr使之转变成+6价Cr(或Cr2O72-),以便于与杂质离子分离; Fe3+和Al3+
(4)Ca2+、Mg2+?
(5)1,?3,?11H2O,2,?1
(6)Fe-2e-=?Fe2+;2H++2e-=H2↑
本题解析:
本题难度:一般
3、选择题 下列哪种物质可以与氧化铁在高温下发生铝热反应
[? ]
A.焦炭
B.一氧化碳
C.氧化铝
D.金属铝粉
参考答案:D
本题解析:
本题难度:简单
4、填空题 某试剂厂用银(含杂质铜)和硝酸(含Fe3+)反应制取硝酸银,步骤如下: 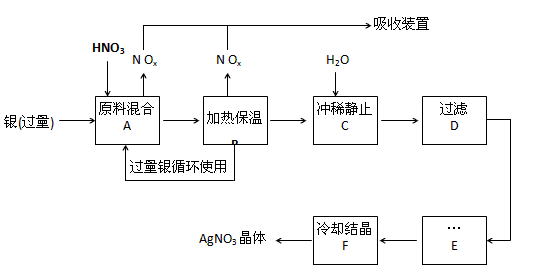
(1)工业上一般选用中等浓度的硝酸和银反应来制取硝酸银。请在下表空格处填空。 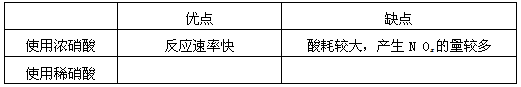
(2)步骤B加热保温的作用是__________ :
a. 有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中H+的浓度
(3)步骤C是为了除去Fe3+、Cu2+等杂质,冲稀时产生沉淀的原因是____________ ;
(4)步骤C中加水的量应该适量,若加入过多的水,对后续步骤造成的不良影响是:_____________ ;
(5)步骤E进行的操作是______________ 。
(6)制得的硝酸银中含有少量硝酸铜,通常除去硝酸铜的方法是在步骤E之前加适量新制的Ag2O,使
Cu2+转化为Cu(OH)2沉淀,反应后过滤除去。该反应的化学方程式为:_______________ 。
参考答案:(1)
(2)a、c
(3)稀释后,H+浓度减小,促进Fe3+、Cu2+的水解
(4)造成步骤D过滤和步骤E蒸发耗时长
(5)蒸发浓缩
(6)Cu(NO3)2+Ag2O+H2O == 2AgNO3+Cu(OH)2
本题解析:
本题难度:困难
5、填空题 以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下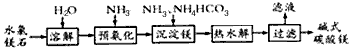
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-1,若溶液中c(OH-)=
3.0×10-6mol/L,则溶液中c(Mg2+)=________________。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为__________________
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00g和标准状况下
CO2 0. 896L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数____ (填“升高”“降低”或“不变”)。
参考答案:(1)2.0 mol/L
(2)NH4Cl
(3)Mg(OH)2·4MgCO3·4H2O
(4)升高
本题解析:
本题难度:一般