时间:2017-03-03 00:05:42
1、选择题 下列说法不正确的是
A.在纯水中加入能水解的盐一定促进水的电离
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.加热CH3COONa溶液,溶液中 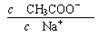 的值将减小
的值将减小
D.常温下醋酸分子不可能存在于pH>7的碱性溶液中
参考答案:D
本题解析:CH3COONa溶液中存在CH3COO—+H2O CH3COOH+OH—,使溶液中的C(OH—)>C(H+)溶液呈碱性,但溶液中一样存在醋酸分子,故D项错误。
CH3COOH+OH—,使溶液中的C(OH—)>C(H+)溶液呈碱性,但溶液中一样存在醋酸分子,故D项错误。
考点:溶液酸碱性及盐类水解平衡。
本题难度:一般
2、选择题 下列比较不正确的是
A.等浓度的NH4HSO4、 NH3·H2O、 (NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的五种溶液,其中(NH4)2Fe(SO4)2溶液中c(NH4+)最大
B.NaClO和BaCl2混合溶液: c(Na+)+2c(Ba2+)=c(ClO-)+c(HClO)+c(Cl-)
C.25 ℃下,0.2 mol·L-1 HCl溶液与0.2 mol·L-1 YOH(一元弱碱)溶液等体积混合(忽略混合后溶液体积的变化),则c(Cl-)=c(Y+)+c(YOH)=0.2 mol·L-1
D.常温下,将0.2 mol·L-1某一元碱ROH溶液和0.1 mol·L-1HCl溶液等体积混 合,混合后溶液pH<7,则c(ROH)>c(R+)
参考答案:C
本题解析:(NH4)2Fe(SO4)2中Fe2+与NH4+离子水解相互抑制,造成NH4+水解程度减小,浓度最大,故A项正确;C项中25 ℃下,0.2 mol·L-1 HCl溶液与0.2 mol·L-1 YOH(一元弱碱)溶液等体积混合(忽略混合后溶液体积的变化),则c(Cl-)=c(Y+)+c(YOH)=0.1 mol·L-1,故C项错误;D项常温下,将0.2 mol·L-1某一元碱ROH溶液和0.1 mol·L-1HCl溶液等体积混 合,溶液溶质为RCl与ROH混合物,均为0.05 mol·L-1,混合后溶液pH<7,说明溶液呈酸性,R+水解程度大于ROH的电离程度,c(ROH)>c(R+),故D项正确;本题选C。
考点:盐类水解、离子浓度大小比较。
本题难度:困难
3、选择题 下列各选项所描述的两个量中,前者大于后者的是
A.NH4Cl溶液中NH4+和Cl-数目
B.纯水在100℃和25℃时的pH
C.完全中和相同pH且相同体积的氨水和NaOH溶液,所需的0.1mol·L-1盐酸体积
D.CH3COONa溶液加水稀释前后的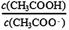
参考答案:C
本题解析:A.NH4Cl是强酸强碱盐,在溶液中NH4+会发生水解反应而消耗,因此NH4+的数目比Cl-数目少,错误;B.纯水在100℃时pH=6,在25℃时的pH=7,前者小,错误; C.由于一水合氨是弱碱,部分电离,所以相同pH且相同体积的氨水和NaOH溶液中溶质的物质的量氨水大于盐酸,所以完全中和相同pH且相同体积的氨水和NaOH溶液,所需的0.1mol·L-1盐酸体积前者大于后者,正确;D.在CH3COONa溶液存在CH3COO-的水解平衡:CH3COO-+ H2O CH3COOH+OH-;加水稀释时平衡正向移动,水解程度增大,前后的
CH3COOH+OH-;加水稀释时平衡正向移动,水解程度增大,前后的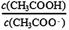 后者大于前者,错误。
后者大于前者,错误。
考点:考查盐的水解、若电解质的电离、溶液的中和能力大小的比较的知识。
本题难度:一般
4、选择题 将FeCl3溶液蒸干灼烧,最后得到固体产物是()
A.无水FeCl3
B.Fe(OH)3
C.FeO
D.Fe2O3
参考答案:D
本题解析:加热有利于水解FeCl3+3H2O ?Fe(OH)3+3HCl,在加热蒸干灼烧条件下,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,在灼烧条件下完全分解生成Fe2O3。
本题难度:一般
5、选择题 下列物质中,既能发生消去反应生成烯烃,又能发生氧化反应生成醛的是( )
A.CH3OH
B.
C.
D.
参考答案:B
本题解析:
本题难度:一般