时间:2017-03-03 00:02:22
1、选择题 NA表示阿伏加德罗常数,下列说法正确的是
A.18gD2O中含有的电子数是10NA
B.1molBaCl2中含有的离子数是2NA
C.7.1gCl2与足量的NaOH溶液反应转移的电子数是0.2NA
D.1molCH4分子中共价键总数是4NA
参考答案:D
本题解析:18gD2O的物质的量不是1mol,而是小于1mol,A不正确。氯化钡中阳离子和阴离子的个数之比是1
本题难度:一般
2、计算题 为测定某碳酸钠样品的纯度,取一定量碳酸钠(Na2CO3)样品投入到40mL未知浓度的盐酸中,两者恰好完全反应(杂质不参与反应),生成二氧化碳气体224mL(标准状况)。
(1)写出该反应的化学方程式________________________________________;
(2)碳酸钠的摩尔质量为___________________;
(3)该碳酸钠样品中碳酸钠的质量为______________;
(4)参与反应的盐酸的物质的量浓度______________;
参考答案:(1) Na2CO3 + 2HCl=2NaCl + CO2↑+ H2O
(2) 106 g·mol-1?(3) 1.06g ; ? (4) 0.5mol/L
本题解析:(1)碳酸钠和盐酸反应生成氯化钠、水和CO2,所以反应的化学方程式是Na2CO3 + 2HCl=2NaCl + CO2↑+ H2O。
(2)碳酸钠的相对分子质量是23×2+12+16×3=106,所以摩尔质量是106g/mol。
(3)生成的CO2的物质的量是0.224L÷22.4L/mol=0.01mol,所以根据反应的化学方程式可知,参加反应的碳酸钠的物质的量也是0.01mol。则根据m=n·M可知,碳酸钠的质量是0.01mol×106g/mol=1.06g。
(4)同样根据反应的化学方程式可知,参加反应的盐酸的物质的量是0.01mol×2=0.02mol,则盐酸的物质的量浓度是0.02mol÷0.04L=0.5mol/L。
点评:该题是基础性试题的考查,该题做题的关键是熟练应用几个关系式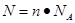 、n=m/M、
、n=m/M、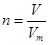 、
、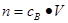 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。该题有利于培养学生的规范答题能力,难度不大,学生不难得分
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。该题有利于培养学生的规范答题能力,难度不大,学生不难得分
本题难度:一般
3、选择题 下列说法不正确的是( )
A.1mol?O2含有1.204×1024个氧原子,在标准状况下占有体积22.4L
B.1mol?O3和1.5mol?O2含有相同的氧原子数
C.等体积、浓度均为1mol/L的磷酸和盐酸,电离出来的氢离子数之比为3:1
D.等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,氧原子数之比为1:3
参考答案:C
本题解析:
本题难度:一般
4、填空题 同温同压下,同体积的氨和硫化氢气体的质量比是???;同质量的氨和硫化氢气体的体积比是?;同质量的氨和硫化氢气体中所含氢原子个数比是?;若两者所含氢原子个数相等,它们的物质的量比是?。
参考答案:1:2? 2:1? 3:1? 2:3
本题解析:同温同压下,同体积的氨和硫化氢气体的摩尔数相同,所以其质量比17:34=1:2;同质量的氨和硫化氢气体的体积比(m/17):(m/34)=2:1;同质量的氨和硫化氢气体中所含氢原子个数比(3m/17):(2m/34)=3:1;若两者所含氢原子个数相等,设为含有1mol氢原子,所以它们的物质的量比(1/3):(1/2)=2:3
点评:本题考查了阿伏加德罗定律的推论的计算,是高考考查的重点和难点,但是本题的难度不大。
本题难度:一般
5、选择题 在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.30mol·L-1和0.15mol·L-1。向该混合液中加入3.20g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度(mol·L-1)是
A.0.225
B.0.25
C.0.45
D.0.50
参考答案:A
本题解析:反应的离子方程式为3Cu+2NO3-+8H+=3Cu2+4+H2O+2NO↑,溶液中NO3-和H+的物质的量分别为0.03mol和0.06mol,所以氢离子是不足的,因此溶解的铜是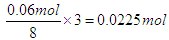 ,所以其浓度是0.225mol/L。答案选A。
,所以其浓度是0.225mol/L。答案选A。
本题难度:一般