时间:2017-03-03 00:01:03
1、选择题 有Na2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的物质的量浓度为0.4 mol/L,SO42-的物质的量浓度为0.7 mol/L,则此溶液中Na+的物质的量浓度为
A.0.1 mol/L
B.0.15 mol/L
C.0.2 mol/L
D.0.25 mol/L
参考答案:C
本题解析:根据溶液中的电荷守恒有:c(Na+) +3 c(Fe3+)="2" c(SO42-) ,有c(Na+) +3×0.4 mol/L="0.7" mol/L×2
c(Na+)=0.2 mol/L
考点:电荷守恒的运用。
本题难度:一般
2、填空题 1 molH2O中含有 mol e—
参考答案:10
本题解析:水分子是由2个H和1个O形成,是由水分子含有1×2+8=10个电子,所以1 molH2O中含有10mol e—
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,0.3mol三氧化硫中含有氧原子数为0.9NA
B.aL甲烷和乙烷混合气体中的分子数为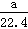 NA
NA
C.5.6 g铁与足量氯气或硫蒸气反应转移的电子数为0.3 NA
D.1L 1mol/L醋酸溶液中离子总数为2NA
参考答案:A
本题解析:A、1个SO3分子中含有3个氧原子,因此常温常压下,0.3mol三氧化硫中含有氧原子数为0.9NA,A正确;B、不能确定气体所处的状态,因此aL甲烷和乙烷混合气体中的分子数不一定为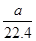 NA,B错误;C、5.6 g铁与足量氯气或硫蒸气反应转移的电子数分别为0.3 NA和0.2 NA,C错误;D、醋酸是弱电解质,存在电离平衡,因此1L 1mol/L醋酸溶液中离子总数小于2NA,D错误,答案选A。
NA,B错误;C、5.6 g铁与足量氯气或硫蒸气反应转移的电子数分别为0.3 NA和0.2 NA,C错误;D、醋酸是弱电解质,存在电离平衡,因此1L 1mol/L醋酸溶液中离子总数小于2NA,D错误,答案选A。
考点:考查阿伏伽德罗常数的计算
本题难度:一般
4、选择题 NA为阿伏加德罗常数,对于1mol/L的硫酸溶液,下列叙述错误的是 (? )
A.1000mL溶液中,含2NA个H+
B.1000mL溶液中,含3NA个离子(H+、SO42-)
C.1000mL溶液中,加入足量Zn,可生成2NA个H2分子
D.1000mL溶液中,加入足量Zn,可生成NA个Zn2+
来源:91考试网 91ExaM.org参考答案:C
本题解析:略
本题难度:简单
5、选择题 取物质的量浓度相等的NaOH和H2SO4溶液,以4:1体积比相混合,所得溶液中的c(OH-)为0.01mol/L,则原溶液的浓度为( )
A.0.01?mol/L
B.0.017?mol/L
C.0.025?mol/L
D.0.250?mol/L
参考答案:令溶液的浓度为cmol/L,NaOH和H2SO4溶液体积分别为4L、1L,
则氢氧化钠的物质的量为cmol/L×4L=4cmol,
硫酸的物质的量为cmol/L×1L=cmol,
氢氧化钠有剩余,硫酸完全反应,则:
2NaOH+H2SO4=Na2SO4+2H2O
2cmol? cmol
故剩余的氢氧化钠为4cmol-2cmol=2cmol
故剩余氢氧根的物质的量也是2cmol
故2cmol=0.01mol/L×(4L+1L)
解得c=0.025
即NaOH和H2SO4溶液为0.025mol/L
故选C.
本题解析:
本题难度:简单