时间:2017-03-03 00:00:43
1、填空题 (12分).铅蓄电池是典型的可充型电池,电池总反应式为: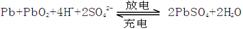
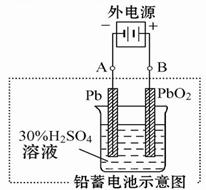
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是______________________ ;电解液中H2SO4的浓度将变 ______ ;当外电路通过1 mol电子时,理论上负极板的质量增加 _______? g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成 _____?___ ,电极反应:__________________ ,B电极反应_______________。
参考答案:(12分,每空2分)
(1)PbO2+2e-+4H++ SO42- = PbSO4 + 2H2O?、小?、 48
(2)Pb? A极反应: PbSO4+2e- =" Pb" + SO42-?
B极反应: PbSO4+2H2O-2e- = PbO2+4H++ SO42-
本题解析:(1)原电池中正极得到电子,发生还原反应。所以根据放电时的方程式可知,正极的电极反应式是PbO2+2e-+4H++ SO42- = PbSO4 + 2H2O。放电是消耗硫酸的,所以硫酸的浓度变小。负极失去电子,发生氧化反应,所以负极电极反应式是Pb-2e-+ SO42- = PbSO4,所以当外电路通过1 mol电子时,理论上负极板的质量增加96g/mol×0.5mol=48g。
(2)根据装置图可知,A电极和电源的负极相连,作阴极,得到电子,所以是二氧化铅得到电子生成单质铅,电极反应式是bSO4+2e- =" Pb" + SO42-。B电极和电源的正极相连,作阳极,硫酸铅失去电子,得到二氧化铅,电极反应式是PbSO4+2H2O-2e- = PbO2+4H++ SO42-。
点评:书写电极反应式的关键是准确判断出原电池的正负极、电解池的阴阳极等。而在电化学的有关计算时,往往常用电子得失守恒。
本题难度:一般
2、选择题 如图所示,a、b是两根石墨棒。下列叙述正确的是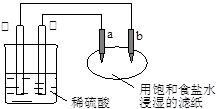
A.a是正极,发生还原反应
B.饱和食盐水pH减小
C.稀硫酸pH增大
D.往滤纸上滴加酚酞试液,a极附近颜色变红
参考答案:C
本题解析:锌比铜活泼,是锌是负极,失去电子。铜是正极,溶液中的氢离子得到电子,pH增大,C正确。a和正极相连,作阳极,A不正确。惰性电极电解饱和食盐水,生成氢氧化钠,碱性增强,B不正确。B是阴极,氢离子放电,产生OH-,所以滴入酚酞溶液显红色,D不正确,答案选C。
本题难度:一般
3、选择题 如图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )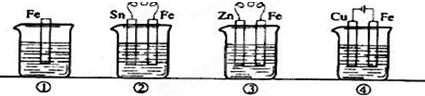
A.③>②>④>①
B.②>①>③>④
C.④>②>③>①
D.④>②>①>③
参考答案:根据图知,②③装置是原电池,在②中,金属铁做负极,③中金属铁作正极,做负极的腐蚀速率快,所以②>③,④装置是电解池,其中金属铁为阳极,被保护腐蚀,有防护腐蚀措施的腐蚀,所以腐蚀速率是:④>②>①>③.
故选D.
本题解析:
本题难度:简单
4、选择题 在钢铁的电化腐蚀中,正极上发生的反应可能是
A.Fe - 2e—=Fe2+
B.O2+4e-+2H2O=4OH-
C.4OH- - 4e-=O2↑+2H2O
D.4Fe(OH)2+O2+2H2O =4Fe(OH)3
参考答案:B
本题解析:钢铁在空气中发生电化学腐蚀时为吸氧腐蚀,铁易失电子发生氧化反应而作负极,负极上电极反应式为:Fe-2e-═Fe2+,碳作正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-═4OH-。
本题难度:一般
5、选择题 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),
如图所示。导致该现象的主要原因是液滴下面的氧气
含量比液滴边缘少。下列说法正确的是
A.(a)区腐蚀比(b)区腐蚀严重
B.该过程发生了化学反应:4Fe+3O2→2Fe2O3
C.该过程是析氢腐蚀,负极反应为:Fe-2e →Fe2+
D.该过程为吸氧腐蚀,正极反应为:O2+2H2O+4e→4OH-
参考答案:D
本题解析:中性环境下,铁发生了电化学腐蚀的吸氧腐蚀,由于液滴下面的氧气含量比液滴边缘少,故(b)区腐蚀严重;
负极:Fe-2e →Fe2+?正极:O2+2H2O+4e→4OH-
故正确的说法是D
本题难度:一般