时间:2017-03-03 00:00:24
1、选择题 对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1 mL稀释至100 mL后,? pH="3"
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为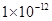
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A.①②
B.①③
C.②④
D.③④
2、选择题 现有物质的量浓度均为 0.1 mol·L - 1 ?的下列五种物质的溶液:①HCl?②H2SO4?
③CH3COOH ?④NH4Cl ?⑤NaOH。下列有关说法正确的是:(?)
A.其溶液中由水电离出的c(H+)的大小关系是① = ②>③>④>⑤
B.其溶液中由水电离出的(H+)的大小关系是④>③>①= ⑤>②
C.上述溶液中能能促进水的电离是②>①=>⑤>③
D.上述溶液中能促进水的电离是只有④
3、选择题 常温下,下列溶液一定呈碱性的是?(?)
A.pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合
B.0.1mol·L-1盐酸和0.1mol·L-1氨水等体积混合
C.0.1mol·L-1氨水和0.1mol·L-1氯水铵溶液等体积混合
D.一定体积pH=5的稀硫酸加水稀释103倍
4、选择题 室温下,水的电离达到平衡:H2O H++OH-。下列叙述正确的是(?)
H++OH-。下列叙述正确的是(?)
A.将水加热,平衡正向移动,KW变小
B.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)增大
C.新制氯水久置后,水的电离平衡正向移动,c(OH-)增大
D.向水中加入少量CH3COONa固体,平衡正向移动,KW增大
5、填空题 (7分)常温下,两种溶液:①0.1 mol/L HAC?②0.1 mol/L NaAC。
(1)溶液①的pH?7(填“>”、“<”或“=”),溶液中离子的电荷守恒的关系式是?。
(2)溶液②呈?性(填“酸”、“碱”或“中”)。其原因是?(用离子方程式表示)。
(3)两种溶液中c(AC-)的大小为?(填序号)。
a. 两种溶液中c(AC-)都等于0.1 mol/L
b. 两种溶液中c(AC-)都小于0.1 mol/L
c. HAC溶液中c(AC-)小于NaAC溶液中c(AC-)
(4)若将①②两溶液按一定的量混合,混合后溶液显中性,则①②两溶液的体积关系是:①?②(填“=”或“>”或“<”)