时间:2017-03-02 23:59:44
1、选择题 将标准状况下的2.24 L CO2通入150 mL 1mol / LNaOH溶液中,下列说法正确的是
A.c(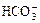 )略大于c(
)略大于c( )
)
B.该溶液只能与酸反应,不能与碱反应
C.c(Na+)等于c( )与c(
)与c(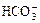 )之和
)之和
D.c(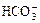 )略小于c(
)略小于c( )
)
参考答案:A
本题解析:略
本题难度:一般
2、选择题 将0.1mol/L的H2S溶液和0.2mol/L NaOH溶液等体积混合,下列关系正确的是 (? )
A.[Na+]>[S2-]>[H+]>[HS-]>[OH-]
B.1/2[Na+]=[S2-]+[HS-]+[H2S]
C.[Na+]+[H+]=1/2[S2-]+[HS-]+[OH-]
D.[S2-]+[HS-] +[H2S] =0.05mol/L
参考答案:BD
本题解析:由0.1mol/L的H2S溶液和0.2mol/L NaOH溶液反应生成0.05mol/L的Na2S溶液。结合盐的电离与水解以及三种守恒关系解答知A、C错误;B、D实质是物料守恒。
本题难度:一般
3、选择题 某溶液中仅含有Na+、H+、OH—、CH3COO-四种离子,下列说法错误的是
A.若溶液中离子间满足:c(CH3COO—)=c(Na+)则该溶液一定呈中性
B.该溶液中一定满足: c(CH3COO—)>c(CH3COOH)>c(OH—)>c(H+)
C.溶液中四种离子之间可能满足:c(Na+)>c(OH-)>c(CH?3COO—)>c(H+)
D.若溶液中的溶质是CH3COONa和CH3COOH,则溶液中离子间一定满足:
c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
参考答案:BD
本题解析:根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH?3COO—)可知,A正确,C正确。B说明溶液显碱性,因此c(OH—)有可能大于c(CH3COOH),B不正确。若溶液中的溶质是CH3COONa和CH3COOH,则溶液不一定显酸性,D不正确。答案选BD。
本题难度:一般
4、选择题 今有两种盐的稀溶液,分别是a mol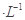 NaX溶液和b mol
NaX溶液和b mol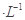 NaY溶液,下列说法不正确的是(? )。
NaY溶液,下列说法不正确的是(? )。
A.若a=b,pH(NaX)>pH (NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)="c" (Y-)+c(HY);则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时, 酸性HX<HY
D.若两溶液等体积混合,测得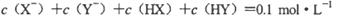
则可推出a+b=0.2 mol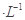
参考答案:A
本题解析:A、若a=b,pH(NaX)>pH (NaY),根据越弱越水解得相同浓度时,酸性HX<HY,错误;B、若a=b,并测得c(X-)="c" (Y-)+c(HY),说明Y-水解程度比X-大,根据越弱越水解解得相同浓度时,酸性HX>HY,正确;C、a>b,测得c(X-)=c(Y-),说明X-水解程度比Y-大,所以有c(HX)>c(HY),且相同浓度时, 酸性HX<HY,正确;D、两溶液等体积混合,则有a="2" [c(X-)+ c(HX) ],b="2" [c(Y-)+ c(HY) ],所以a+b=2×0.1mol/L=0.2 mol/L,正确,答案选A。
本题难度:一般
5、填空题 有盐AmBn的溶液。(1)若为强酸弱碱盐,是水解的离子方程式是:?。(2)若为弱酸强碱盐,是水解的离子方程式是:?。
参考答案:①An++nH2O A(OH)n+nH+;②Bm-+H2O
A(OH)n+nH+;②Bm-+H2O HB(m-1)-+OH-。
HB(m-1)-+OH-。
本题解析:若为强酸弱碱盐,弱碱的阳离子的水解的离子方程式一步写出,即An++nH2O A(OH)n+nH+;若为弱酸强碱盐,弱酸的阴离子的水解的离子方程式要分步来写,但一般以第一步为主,后面由于太弱可省略,即Bm-+H2O
A(OH)n+nH+;若为弱酸强碱盐,弱酸的阴离子的水解的离子方程式要分步来写,但一般以第一步为主,后面由于太弱可省略,即Bm-+H2O HB(m-1)-+OH-。
HB(m-1)-+OH-。
本题难度:一般