时间:2017-03-02 23:51:50
1、选择题 下列叙述正确的是 (? )
A.太阳能电池的主要材料是高纯度的二氧化硅
B.C3N4和Si3N4结构相似,是新型的有机高温结构陶瓷
C.Al2O3和Na2SiO3,都可作耐火材料
D.工业上常用电解NaCl溶液来制备金属钠
参考答案:C
本题解析:略
本题难度:简单
2、选择题 下列离子方程式书写不正确的是(?)
A.往NaOH溶液中通入过量CO2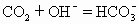
B.单质硅与烧碱溶液反应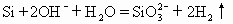
C.石英砂与烧碱反应制水玻璃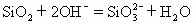
D.往水玻璃中通入二氧化碳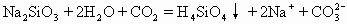
参考答案:D
本题解析:往NaOH溶液中通入适量CO2生成正盐Na2CO3,正盐能与酸反应变为酸式盐,所以当CO2过量时即溶液中H2CO3过量时,生成物为NaHCO3,故A式正确。
单质硅能和烧碱溶液反应生成硅酸钠和氢气,NaOH是易溶于水的强碱,Na2SiO3。是易溶于水的盐,均完全电离,故Na+可以简化掉,B式正确。
石英的成分是二氧化硅与烧碱液发生复分解反应生成硅酸钠和水。故C式正确。
碳酸比硅酸酸性强,所以往水玻璃即硅酸钠的水溶液中通入二氧化碳可以制硅酸。反应物中的Na2SiO3和生成物中的Na2CO3均为易溶于水的盐,能完成电离写成离子式,并且Na+可以简化掉,故D式不正确。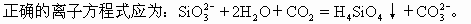
本题难度:简单
3、选择题 把过量的CO2通入下列溶液中,最终不会产生沉淀的是
A.Na2SiO3
B.CaCl2
C.NaAlO2
D.饱和Na2CO3
参考答案:B
本题解析:A、硅酸钠可以和碳酸反应生成碳酸钠和硅酸,硅酸是白色不溶于水的沉淀;B.盐酸是强酸,碳酸是弱酸,所以碳酸不能制取盐酸,即二氧化碳和氯化钙不反应,最终没有沉淀析出;C、碳酸酸性大于氢氧化铝,将二氧化碳通到偏铝酸钠的溶液中,会产生氢氧化铝白色沉淀; D、碳酸钠与二氧化碳和水反应生成溶解度较小的NaHCO3而析出。
本题难度:一般
4、选择题 下列有关硅及其化合物的说法错误的是
A.硅的导电性能介于导体和绝缘体之间,是良好的半导体材料
B.二氧化硅属于酸性氧化物,不能与任何酸反应
C.硅酸可通过可溶性硅酸盐与其他酸反应制得,硅酸干凝胶常用作干燥剂
D.硅酸钠的水溶液俗称水玻璃,可作木材防火剂
参考答案:B
本题解析:A 对 硅是良好的半导体材料
B 错 二氧化硅能与氢氟酸反应
C 对?只要酸性比硅酸强,那么,这种酸就可以和可溶性硅酸盐反应,制的硅酸,
D 对?硅酸钠的水溶液可作木材防火剂
本题难度:简单
5、填空题 硅酸钠是一种重要的无机功能材料,某研究性学习小组设计的利用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的流程如下: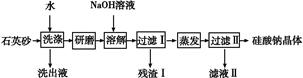
(1)石英砂加水洗涤的目的是?。
研磨后加入NaOH溶液溶解的离子方程式是? 。
(2)实验室进行蒸发操作要用到的仪器有铁架台(含铁圈)、 和 。
(3)残渣Ⅰ的成分是 (填化学式)。将残渣Ⅰ溶于盐酸,再加入NaOH溶液得到沉淀,将该沉淀加入到NaClO和NaOH混合溶液中可制得一种优质净水剂,完成反应的离子方程式: + ClO-+ OH- + Cl-+ H2O
+ Cl-+ H2O
(4)按上述流程制得的硅酸钠晶体可表示为Na2O·nSiO2,若石英砂的质量为10.0 g,其中含SiO2的质量分数为90%,最终得到硅酸钠晶体15.2 g,则n= 。
参考答案:(1)除去氯化钠等可溶性杂质 SiO2+2OH- Si
Si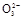 +H2O
+H2O
(2)玻璃棒 蒸发皿
(3)Fe2O3 2 Fe(OH)3 3 4 2 Fe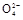 3 5
3 5
(4)1.5
本题解析:(1)石英砂中含有可溶性杂质氯化钠,加水溶解可除去,氢氧化钠和二氧化硅反应生成硅酸钠。
(2)蒸发溶液要选择蒸发皿,为防止受热不均液体溅出,用玻璃棒搅拌。
(3)Fe2O3不和氢氧化钠反应,故残渣为Fe2O3,根据电荷守恒配平。
(4)10 g石英砂中SiO2占了90%,则SiO2的物质的量为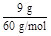 ="0.15" mol,硅酸钠晶体的质量为15.2 g,则氧化钠的质量为15.2 g-9 g="6.2" g,故氧化钠的物质的量为0.1 mol,n(Na2O)∶n(SiO2)="0.1" mol∶0.15 mol=1∶1.5,故n=1.5。
="0.15" mol,硅酸钠晶体的质量为15.2 g,则氧化钠的质量为15.2 g-9 g="6.2" g,故氧化钠的物质的量为0.1 mol,n(Na2O)∶n(SiO2)="0.1" mol∶0.15 mol=1∶1.5,故n=1.5。
本题难度:一般