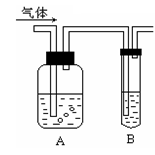
HNO3酸化的AgNO3溶液
参考答案:B
本题解析:考查元素及其化合物知识
A:SO2可被酸性KMnO4溶液吸收,而CO2气体通往品红溶液无明显现象
B:Cl2、HCl两气体均不会被硫酸吸收,Cl2可氧化KI生成碘单质,从而使淀粉呈蓝色
C:NH3被浓硫酸吸收,而CO2 通入酚酞试液中仍为无色溶液,无明显现象
D:HCl与饱和NaHCO3溶液反应生成CO2,而CO2气体通往HNO3酸化的AgNO3溶液中不发生任何反应,无明显现象
故答案为B
本题难度:一般
3、选择题 下列能够用酒精灯加热的仪器是
A.量筒
B.烧杯
C.容量瓶
D.蒸发皿
参考答案:BD
本题解析:能够用酒精灯加热的仪器是烧杯和蒸发皿,量筒以及容量瓶不能,答案选BD。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。关键是要熟练记住常见仪器的使用注意事项。该类试题需要注意的是可以加热的化学仪器有:①试管:直火加热,一般用量少的实验,不能用酒精喷灯加热;②蒸发皿:直火加热,一般用于蒸发溶液结晶;③坩埚:直火加热,一般用于熔化熔点高的反应物;④烧杯:隔石棉网加热,一般用于加热溶液,加速反应;⑤烧瓶:隔石棉网加热,一般用于溶液间反应;⑥蒸馏烧瓶:隔石棉网加热,一般用于蒸馏溶液提纯。
本题难度:简单
4、实验题 (6分)实验室配制480 mL 0.1 mol·L-1Na2CO3溶液,完成下列问题:
(1)应用托盘天平称取无水碳酸钠粉末__________g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠粉末是__________g(1 g以下用游码)。
(3)配制Na2CO3溶液时需用的主要仪器有__________、__________、__________、__________、__________。
(4)使用容量瓶配制溶液时,下列情况会使所配溶液浓度偏低的是__________。
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了?②无水碳酸钠粉末已部分吸水变成晶体?③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤?④转移溶液前容量瓶内有少量蒸馏水?⑤定容时,俯视容量瓶的刻度线?⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
参考答案:(1)5.3?(2)4.7?(3)500 mL容量瓶?托盘天平?玻璃棒?胶头滴管?烧杯?(4)①②③⑥
本题解析:在实验室中不存在480 mL的容量瓶,所以应取500 mL的容量瓶配制溶液。若物品与砝码的位置颠倒,当不使用游码时,不产生误差;当使用游码时,物品的质量为砝码的质量减去游码指示的质量,也就是比应称量的质量少游码指示的质量的二倍。
在进行误差分析时,可以从公式 c=n/V着手分析。
本题难度:一般
5、实验题 (12分)纳米TiO2在涂料、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
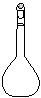 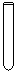 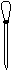 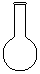 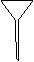
a b c d e
(2)滴定终点的现象是___________________________________________________。
(3)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
(4)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使配制结果______________。
②若在配制标准溶液过程中,俯视液面,使测定结果_________。
参考答案:(1)抑制NH4Fe(SO4)2水解?,a? c?(2)溶液变为红色
(3)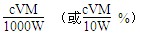 ?(4)①偏低?②偏高 ?(4)①偏低?②偏高
本题解析:(1)由于NH4+和Fe2+都水解,溶液显酸性,所以加入硫酸的目的是抑制NH4Fe(SO4)2水解;根据配制原理可知,还需要容量瓶和胶头滴管,答案选ac。
(2)因为是用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3。
(3)根据得失电子守恒,有:1Ti3+~1Fe3+,故n(Fe3+)= n(Ti3+)= n(TiO2)=cV×10-3mol,其质量分数为
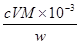 。 。
(4)根据c=n/V可知, NH4Fe(SO4)2溶液溅出,则溶质减少,物质的量浓度减小;若俯视读数,则容量瓶中溶液的体积减少,浓度偏大。
本题难度:一般
|