时间:2017-03-02 23:41:19
1、选择题 CO2、BF3、CCl4都是非极性分子,NH3、H2S都是极性分子,由此推出ABn型分子是非极性分子的经验规律,正确的是(? )
A.所有原子在同一平面内
B.分子中不含有氢原子
C.A的化合价等于主族序数(n>1)
D.A的相对原子质量小于B
2、选择题 下列化学用语正确的是
[ ? ]
A.钙离子的电子式 Ca2+
B.甲基的电子式 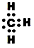
C.原子核内有8个中子的碳原子 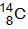
D.乙烷的分子式 CH3CH3
3、选择题 下列元素两两结合形成的化合物既有以离子键相结合的又有以共价键相结合的是( )
A.H? O K
B.Mg K Cl
C.C H O
D.Mg N Ne
4、选择题 下列物质中,含有共价键的离子化合物是( )
A.CaCl2
B.H2O
C.NH4Cl
D.CH4
5、选择题 下列叙述正确的是( )
A.共价化合物中只含有共价键
B.共价化合物中一定存在离子键
C.离子化合物中不能存在共价键
D.离子化合物中只含有离子键