时间:2017-03-02 23:34:08
1、选择题 面对日益恶化的地球生态环境,联合国环境规划署建议“低碳生活方式”降低二氧化碳等温室气体的排放,人人行动来保护我们生存的家园.下列说法正确的是( )
A.CO2的比例模型为
B.用过氧化钠吸收CO2是目前比较经济的减碳方案
C.16O=C=18O与16O=C=16O互为同位素且化学性质相似
D.从我做起节电、节气等低碳生活方式可减少温室气体排放量
参考答案:D
本题解析:
本题难度:一般
2、选择题 图中a、b、c、d、e、f表示元素周期表中部分短周期元素,下列叙述正确的是( )
A.a、b、c的简单离子中,c的离子半径最大
B.c、d、f最高价氧化物对应的水化物两两之间均可发生反应
C.e的氢化物比f的氢化物的稳定性高
D.a、e可形成一种新型无机非金属材料--高温结构陶瓷
参考答案:a、b、c、d、e、f是短周期元素,由各元素在元素周期表中位置可知,a为氮元素、b为氧元素、c钠元素、d为铝元素、e为硅元素、f为氯元素.
A、a为氮元素、b为氧元素、c钠元素,原子形成的离子电子层结构相同,电子层结构相同,核电荷数越大离子半径越小,所以a、b、c的简单离子中,c的离子半径最小,故A错误;
B、c钠元素、d为铝元素、f为氯元素,最高价氧化物对应的水化物为氢氧化钠、氢氧化铝、高氯酸,氢氧化铝是两性氢氧化物,溶于氢氧化钠、高氯酸溶液,氢氧化钠与高氯酸发生中和反应,故B正确;
C、e为硅元素、f为氯元素,非金属性Si<Cl,非金属性越强,氢化物越稳定,所以f的氢化物的稳定性高,故C错误;
D、a为氮元素、e为硅元素,氮化硅是一种新型无机非金属材料--高温结构陶瓷,故D正确.
故选BD.
本题解析:
本题难度:一般
3、选择题 下图是元素周期表的一部分,下列说法正确的是?
[? ]
A.阴影部分元素在周期表中处于第ⅣA族
B.H3AsO4的酸性大于H3PO4
C.根据NaH的存在,也可把氢元素放在第ⅦA族
D.向硅酸钠溶液中加入盐酸可证明氯的非金属性强于硅
参考答案:C
本题解析:
本题难度:简单
4、填空题 下表是元素周期表中的一部分。? 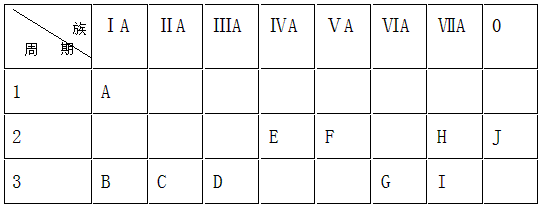
根据A-J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是____________,氧化性最强的单质是____________ ,还原性最强的单质是 _________。
(2)最高价氧化物对应的水化物中,碱性最强的是 _________,酸性最强的是__________ ,呈两性的是_____________ 。
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是_____________ 。
(4)在B、C、D、G、I中,原子半径最大的是_______________ 。
参考答案:(1)Ne ;F2 ;Na
(2)NaOH ;HClO4 ;Al(OH)3
(3)HF
(4)Na
本题解析:
本题难度:一般
5、选择题 下列有关物质性质的比较顺序中,错误的是( )
A.酸性:HClO4>H2SO4>H3PO4>H2SiO3
B.微粒半径:K+>Na+>Mg2+>Al3+
C.热稳定性:HF<HCl<HBr<HI
D.熔点:Li>Na>K>Rb
参考答案:A.非金属性:Cl>S>P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,
则有:酸性:HClO4>H2SO4>H3PO4>H2SiO3,故A正确;
B.K+核外有3个电子层,离子半径最大,Na+、Mg2+、Al3+都有2个电子层,核外电子排布相同的离子,核电核数越大,半径越小,则有微粒半径:K+>Na+>Mg2+>Al3+,故B正确;
C.非金属性:F>Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,则热稳定性:HF>HCl>HBr>HI,故C错误;
D.碱金属元素从上到下,原子半径逐渐增大,金属键作用力逐渐减小,金属单质的熔点逐渐降低,
则熔点:Li>Na>K>Rb,故D正确.
故选C.
本题解析:
本题难度:简单