时间:2017-03-02 23:30:50
1、简答题 氢氧化镁用于制药工业,还是重要的绿色阻燃剂.
I.治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2.
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式为______;
II.已知:Mg(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H1=-441kJ?mol-1
H2O(g)=H2(g)+
| 1 2 |
| 1 2 |
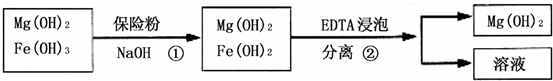
| 精制阻燃剂的条件 | 阻燃剂铁含量 序号 提纯体系温度/℃ 加入EDTA质量/g 加入保险粉质量/g W(Fe)/(10-4g) 1 40 0.05 0.05 7.63 2 40 0.05 0.10 6.83 3 60 0.05 0.10 6.83 4 60 0.10 0.10 6.51 | |||
参考答案:(1)氢氧化镁和盐酸反应产生氯化镁和水,反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(2)Mg(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H1=-441kJ?mol-1 ①
H2O(g)=H2(g)+12O2(g)△H2=242kJ?mol-1②
Mg(s)+12O2(g)=MgO(s)△H3=-602kJ?mol-1③
方程式③+②-①得:Mg(OH)2(s)=MgO(s)+H2O(g);△H=81KJ/mol,
故答案为:Mg(OH)2(s)=MgO(s)+H2O(g);△H=81KJ/mol;
(3)每消耗0.1mol保险粉(Na2S2O4)转移0.6mol?e-,所以S2O42-被氧化为硫酸根离子,氢氧化铁被还原为氢氧化亚铁,发生的离子方程式为:6Fe(OH)3+S2O42-+2OH-=6Fe(OH)2+2SO42-+4H2O.
?故答案为:6Fe(OH)3+S2O42-+2OH-=6Fe(OH)2+2SO42-+4H2O;
(4)Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2(s)=Fe2+(aq)+2OH-(aq)当不断滴入EDTA时,EDTA将结合Fe 2+促使平衡向右移动而使Fe(OH)2不断溶解.
故答案为:Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2(s)=Fe2+(aq)+2OH-(aq)当不断滴入EDTA时,EDTA将结合
Fe 2+促使平衡向右移动而使Fe(OH)2不断溶解;
(5)观察实验2、3知,其它条件相同时,温度不同,铁含量相同,采取低温能抑制氢氧化镁的溶解,所以采用低温较好.
观察实验3、4知,其它条件相同时,EDTA质量越大,含铁量越低,所以选取EDTA质量为0.10g.
观察实验1、2知,其它条件相同时,保险粉质量越大,含铁量越低,所以选取保险粉质量为0.10g
故选C.
本题解析:
本题难度:一般
2、选择题 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
[? ]
A.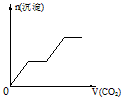
B.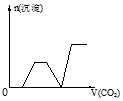
C.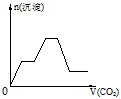
D.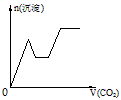
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
[?]
A.Na2CO3和盐酸
B.AlCl3和NaOH
C.NaAlO2和硫酸
D.Na2CO3和BaCl2
参考答案:D
本题解析:
本题难度:一般
4、选择题 比较镁和铝与盐酸反应的难易程度,在两个实验中需控制不相同的实验条件是( ? )
A.镁片与铝片的形状和大小
B.盐酸的浓度
C.盐酸的体积
D.产生气体的体积
参考答案:D
本题解析:
本题难度:简单
5、选择题
小林查阅资料获得有关物质燃烧的新信息:(1)2Na+Cl2 2NaCl ? ? (2)2Mg+CO2
2NaCl ? ? (2)2Mg+CO2 2MgO+C.由此形成以下几点认识:①工业上常用反应(1)生产食盐?②使用CO2灭火应有所选择③燃烧不一定要有氧气参与,其中有关认识正确的是( )
2MgO+C.由此形成以下几点认识:①工业上常用反应(1)生产食盐?②使用CO2灭火应有所选择③燃烧不一定要有氧气参与,其中有关认识正确的是( )
参考答案:B
本题解析:
本题难度:简单