时间:2017-03-02 23:24:14
1、选择题 已知有如下反应:①2BrO3-+Cl2=Br2+2ClO3-,②ClO3-+5Cl-+6H+==3Cl2+3H2O,③2FeCl3+2KI==2FeCl2+
2KCl+I2,④2FeCl2+Cl2==2FeCl3。下列叙述正确的是
[? ]
A.氧化能力:ClO3->BrO3->Cl2>Fe3+>I2
B.还原能力:Fe2+> I- >Cl-
C.反应ClO3-+Br- =Cl- + BrO3-能顺利进行
D.氧化能力:BrO3->ClO3->Cl2>Fe3+>I2
参考答案:D
本题解析:
本题难度:一般
2、选择题 已知:①X+Y2+ = X2++Y;②Z+2H2O(冷水)= Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W和稀硫酸组成的原电池的电极反应式为:2H++2e- = H2↑,Y- 2e- =Y2+。由此可知X、Y、W、Z的还原性由强到弱的顺序是
[? ]
A.X>Z>Y>W
B.Z>W>X>Y
C.Z>X>Y>W
D.Z>Y>X>W
参考答案:C
本题解析:
本题难度:一般
3、填空题 向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式 。
(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为 色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
参考答案:(1)I2+5Cl2+6H2O=2HIO3+10HCl
(2)KI、I2 (3)红棕 HBrO3>Cl2>HIO3 (4)10.58
本题解析:(1)CCl4层变成紫色说明有I2生成,继续滴加氯水变成无色,说明I2又被氧化生成HIO3,同时生成HCl。(2)首先KI被氧化生成I2,后来I2又被氧化生成KIO3,所以整个过程中的还原剂是KI、I2。(3)Br2的CCl4溶液显红棕色;继续滴加氯水,CCl4层颜色没有变化,说明氯水能氧化I2但不能氧化Br2,结合第(1)问可得氧化性HBrO3>Cl2>HIO3。(4)KI被Cl2氧化成KIO3,对应关系式为
I- ~ KIO3 ~ 3Cl2
1 mol 3 mol mol n(Cl2)
mol n(Cl2)
则n(Cl2)= mol,V(Cl2)=
mol,V(Cl2)= mol×22.4 L·mol-1≈10.58 L。
mol×22.4 L·mol-1≈10.58 L。
本题难度:一般
4、选择题 稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。
已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+。下列说法正确的是( )
A. Ce、
Ce、 Ce、
Ce、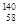 Ce、
Ce、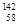 Ce它们互称为同素异形体
Ce它们互称为同素异形体
B.工业上可以采用电解氯化铈水溶液来获得铈单质
C.铈溶于氢碘酸的主要化学方程式可表示为2Ce+6HI=2CeI3+3H2↑
D.工业上金属铈一般保存在敞口容器中
参考答案:C
本题解析:A互为同位素,错误;铈与水、空气反应,B、D错误;由信息可知Ce4+>Fe3+,铁与酸反应时不能被H+氧化成Fe3+,所以H+也不能把Ce氧化成Ce4+,即Ce与非氧化性酸反应生成Ce3+,C正确。
本题难度:一般
5、填空题 向盛有KI溶液的试管中加入少许CCl4后滴加新制的氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
__ +___
+___ +__
+__ →___HIO3+___
→___HIO3+___
(2)把KI换成KBr,则CCl4层变为________色;继续滴加氯水,CCl4层的颜色没有变化。则Cl2、HIO3、HBrO3的氧化性由强到弱的顺序是____________________。
参考答案:(1)I2+5Cl2+6H2O=2HIO3+10HCl
(2)橙红;HBrO3>Cl2>HIO3
本题解析:
本题难度:一般