时间:2017-03-02 23:19:56
1、选择题 下列化学用语或图示表达正确的是
[? ]
A.乙烯的比例模型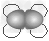
B.Na+的结构示意图
C.葡萄糖的分子式的最简式C6H12O6
D.CO2的电子式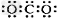
参考答案:A
本题解析:
本题难度:简单
2、填空题 将多磷酸钠溶液通过氢型阳离子交换柱,进行Na+与H+的交换,得到多磷酸。经科学研究表明,磷酸和多磷酸的结构分别为:?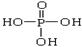 (磷原子几乎处在四面体的中心,三个羟基性质几乎完全相同)?
(磷原子几乎处在四面体的中心,三个羟基性质几乎完全相同)?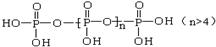
交换后的溶液用0.1 mol·L-1的NaOH溶液滴定。在消耗NaOH溶液 42.00mL和50.00mL时各有一个滴定终点。请回答:
⑴有2个滴定终点的原因是?。
⑵n的值为?,写出计算依据?。
?
参考答案:⑴多磷酸分子中有两种不同类型的—OH?
⑵n=21; n/(n+4)=42.00/50.00
本题解析:略
本题难度:简单
3、填空题 (15分)已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为?。
(2)B、C、D的第一电离能由小到大的顺序为?。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是?.
(4)E的最高价氧化物分子的空间构型是?。其中心原子的杂化方式为?。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为?。
(6)A、F形成某种化合物的晶胞结构如图所示,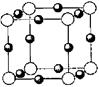 则其化学式为?;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为??g/cm3。
则其化学式为?;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为??g/cm3。
参考答案:(1)3s23p63d10 ?(2)Na<Al<Si (3)氨分子与水分子之间存在氢键
(4)平面正三角形 SP2?(5) 4?(6)Cu3N ?103∕(4a3NA)
本题解析:根据题意可推知:A是N;B是Na;C是Al;D是Si;E是S;F是Cu。(1)Cu的原子的M层电子排布式为3s23p63d10;(2)一般情况下同一周期的元素,原子序数越大,元素的第一电离能就越大,所以Na、Al、Si的第一电离能由小到大的顺序为Na<Al<Si;(3)A的简单氢化物分子NH3极易溶于水是因为氨分子与水分子都是极性分子,根据相似相溶原理氨气容易在水中溶解,而且在氨分子与水之间存在氢键。也增加了分子之间的相互作用力。(4)S的最高价氧化物分子SO3的空间构型是平面正三角形;其中心原子S原子的杂化方式为SP2 。(5)Cu2+与NH3能够结合形成络离子[Cu(NH3)4]2+.配位数为4.(6)在一个晶胞中含有的N原子数是:8×1/8=1;含有的Cu原子的个数是12×1/4=3.因此其化学式为Cu3N;由于紧邻的白球与黑球之间的距离为a cm,则晶胞的边长是2acm。在一个晶胞中含有一个Cu3N。所以该晶胞的密度为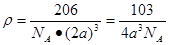 。
。
本题难度:一般
4、选择题 共价键的断裂有均裂和异裂两种方式,即均裂: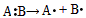 ,异裂:
,异裂: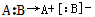 。下列化学反应中发生共价键均裂的是
。下列化学反应中发生共价键均裂的是
[? ]
A. 2K+2H2O=2KOH+H2↑
B. 2Na+2C2H5OH→2C2H5ONa+H2↑
C.?Na2CO3+ H2O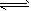 NaHCO3 + NaOH
NaHCO3 + NaOH
D. CH3COOH +C2H5OH H2O+CH3COOC2H5
H2O+CH3COOC2H5
参考答案:D
本题解析:
本题难度:简单
5、选择题 S2Cl2是广泛用于橡胶工业的硫化剂,常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与H2O2类似.下列说法错误的是( )
A.S2Cl2分子中的两个S原子均是sp3杂化
B.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
C.S2Br2与S2Cl2结构相似,熔沸点S2Br2>S2Cl2
D.S2Cl2分子中的S为+1价,是含有极性键和非极性键的非极性分子
参考答案:A、S2Cl2分子中每个S原子价层电子对数=2+2=4,所以采取sp3杂化,故A正确.
B、S2Cl2中的硫元素为中间价态(+1价),在反应过程中一部分升高到+4价(生成SO2),一部分降低到0价(生成S),符合氧化还原反应原理,故B正确.
C、S2Br2与S2Cl2均属于分子晶体,分子晶体中,分子量越大则熔沸点越高,所以熔沸点:S2Br2>S2Cl2,故C正确.
D、S2Cl2的结构类似于H2O2的结构,为Cl-S-S-Cl,其中的S-S为非极性键,S-Cl键为极性键,但正负电荷中心不重合,所以是极性分子,故D错误.
故选D.
本题解析:
本题难度:一般