时间:2017-03-02 23:11:44
1、实验题 硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
请填写以下空白:
【提出问题】Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①:____________。
猜想②:溶液呈中性,且不与酸反应。
猜想③:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想②、③,设计实验方案。请填写下列表格中的(1)(2)(3)。
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
(1).甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由___________________。
(2).请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是____________________________________________。
参考答案:
【提出问题】猜想①:与BaCl2溶液反应有沉淀生成?
【实验探究】
【问题讨论】
(1).不正确。因氯水过量,氯水中同样含有Cl-
(2).取少量反应后的溶液,向其中滴入氯化钡溶液,若观察到有白色沉淀产生,则说明Na2S2O3能被氯水氧化
本题解析:
本题难度:困难
2、选择题 中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
A.用一定量NaOH稀溶液和稀盐酸反应测得的中和热数据,来推算一定量稀H2SO4和NaOH稀溶液反应的反应热
B.用沸点数据推测能否用蒸馏的方法将两种液体混合物进行分离
C.用反应热数据的大小判断不同反应的反应速率大小
D.用原子(或离子)半径数据推断同周期或同主族某些原子(或离子)氧化性或还原性的强弱
参考答案:C
本题解析:A 正确,用稀的强酸和强碱反应,反应也不生成沉淀,就能测得中和热数据
B 正确,可以用沸点数据推测,如果两种液体沸点相差很大,就能用蒸馏的方法分离。
C 错误,反应速率的快慢与反应热的数据没有关系。
D 正确,原子(或离子)半径越小,得电子能力越强,氧化性越强,半径越大,失电子能力越强,还原性越强。
本题难度:一般
3、实验题 (12分)某实验小组利用如下图所示装置完成有关实验。
(1) 有关 气体的制取、收集、尾气处理问题
气体的制取、收集、尾气处理问题
①仪器a的名称:__________,若装置I用于制取SO2,则反应的化学方程式为: __________
装置III可用于气体的吸收,若用于吸收Cl2,则IH中所盛放液体为____________________
A.水
B.浓硫酸
C.NaOH溶液
D.饱和NaCl溶液
②装置II可以是收集装置也可以是洗气装置.若用来收集N0,请简述其操作方法:____________________
(2) 比较碳、硅两种元素的非金属性强弱(a中装的盐酸、装置II中装有Na2SiO3溶液)
则装置II中盛放的溶液为____________________
装置III中反应的离子方程式为____________________
参考答案:
本题解析:略
本题难度:一般
4、简答题 我国化工专家侯德榜发明的侯氏制碱法的化学原理是将二氧化碳通入氨水的氯化钠饱和溶液中,其化学反应方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(1)在实验室中利用上述原理从反应所得溶液中分离出碳酸氢钠晶体的实验操作称为______,该装置使用的玻璃仪器有玻璃棒、______、______.
(2)实验所得碳酸氢钠晶体中,可能含有的杂质离子有Cl-和NH4+,实验室鉴定Cl-所选用的试剂是______,所发生反应的离子方程式为:______;鉴定另一种杂质离子NH4+的实验检验方法是______.
(3)碳酸氢钠晶体受热分解可得到纯碱,其化学反应方程式为______.
参考答案:(1)提取液体中的固体并使其分离一般采用过滤的方式完成,过滤操作中用到的玻璃仪器主要有:烧杯、玻璃棒、漏斗,故答案为:过滤;烧杯;漏斗;
(2)实验室对溶液中氯离子的检验方法是:加入硝酸酸化的硝酸银溶液,如果由白色沉淀生成则可判断原溶液中存在氯离子,反应的离子方程式为Cl-+Ag+=AgCl↓;铵根离子的检验方法是:加入碱性较强的溶液并加热,如果能生成使湿润的紫色石蕊试纸变蓝的气体,则可证明铵根离子的存在,其原理是铵盐遇碱会生成氨气
故答案为:AgNO3溶液、稀HNO3;Cl-+Ag+=AgCl↓;取少量固体与强碱溶液混合加热,生成的气体用湿润的红色石蕊试纸检验;
(3)碳酸氢钠受热分解会生成碳酸钠、二氧化碳和水,反应的化学方程式为2NaHCO3?△?.?Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3?△?.?Na2CO3+CO2↑+H2O.
本题解析:
本题难度:一般
5、实验题 (15分)
请设计CO2在高温下与木炭反应生成CO的实验。
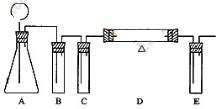
(1)在下面方框中,A表示有长颈漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置,连接胶 管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:
管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:
(2)根据方框中的装置图,在答题卡上填写该表
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | 石灰石、稀盐酸 | 石灰石与盐酸生成CO2 |
| ? | ? | ? |
参考答案:
(1)
(2)
仪器标号
仪器中所加物质
作用
B
饱和碳酸氢钠溶液
除去CO2中的HCl气体
C
浓硫酸
除去CO2中的水气
D
干燥木炭粉
与CO2反应产生CO
E
澄清石灰水
吸收未反应的CO2
?
(3)通过控制酸的量来控制产生气体的快慢;同时小试管中充满盐酸,可以起到液封作用,防止反激烈时气体经漏斗冲出;
(4)点燃气体,火焰呈蓝色,再用一个内壁附有澄清石灰水的烧杯罩在火焰上,烧杯内壁的石灰水变浑浊。
本题解析:略
本题难度:简单