时间:2017-03-02 22:50:17
1、选择题 已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+离子或
[Zn(OH)4]2-离子的物质的量浓度(假设Zn2+离子浓度为10-5mol·L-1时,Zn2+离子已沉淀完全)。下列说法不正确的是 
[? ]
A.往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:Zn2++4OH-=[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17
C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8~12
D.向1L 1 mol·L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH 0.2mol
参考答案:D
本题解析:
本题难度:一般
2、填空题 以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
(1)硫酸渣的成分中属于两性氧化物的是 , 写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: ;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
参考答案:32. (16分)(1) Al2O3 Fe2O3 + 6H+ ==2Fe3+ + 3H2O
(2)3.2—3.8 (3) SiO2 Al2(SO4)3 (4) 14m/15w
本题解析:(1)硫酸渣中含Fe2O3、SiO2、Al2O3、MgO,属于两性氧化物的是Al2O3,氧化铁是碱性氧化物,可以和硫酸反应生成硫酸铁和水,即Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,离子反应方程式为:Fe2O3 + 6H+ ==2Fe3+ + 3H2O(2)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH需介于3.2和3.8之间;答案为:3.2~3.8,(3)因二氧化硅不与硫酸反应,“滤渣A”主要成份的化学式为SiO2.未沉淀的离子为Na+、Mg2+、Al3+,滤液B可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4;(4)铁红制备过程中,铁元素损耗25%,,最终得到铁红的质量为m kg,铁元素的质量为(1000m×112/160)÷75%=14m/15,则原来硫酸渣中铁元素质量分数为14m/15w。
考点:考查物质的性质,离子方程式的书写,元素及其化合物的性质等知识。
本题难度:困难
3、选择题 室温下,下列叙述正确的是
A.pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:c(H+) + c(M+)=c(OH-) + c(A-)
B.对于0.1mol/LNa2SO3溶液:c(Na+)=2c(SO32-) + c(HSO3-) + 2c(H2SO3)
C.等浓度、等体枳的Na2CO3和NaHCO3混合: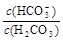 >
>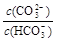
D.将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③
参考答案:AC
本题解析:A、根据电荷守恒可知:溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数,所以pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:c(H+) + c(M+)=c(OH-) + c(A-),故A正确;B、根据物料守恒,对于0.1mol/LNa2SO3溶液:c(Na+)=2c(SO32-) + 2c(HSO3-) + 2c(H2SO3),故B错误;C、等浓度、等体枳的Na2CO3和NaHCO3混合: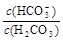 >1,
>1,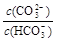 <1,所以
<1,所以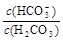 >
>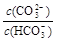 ,故C正确;D、②10mL0.2mol/LMgC12,Cl?浓度为0.4mol?L?1,③20mL0.3mol/L盐酸,Cl?浓度为0.3mol?L?1,溶解至饱和时c(Ag+):①>③>②,故D错误。
,故C正确;D、②10mL0.2mol/LMgC12,Cl?浓度为0.4mol?L?1,③20mL0.3mol/L盐酸,Cl?浓度为0.3mol?L?1,溶解至饱和时c(Ag+):①>③>②,故D错误。
考点:本题考查离子浓度比较。
本题难度:困难
4、选择题 AgCl固体溶解在水中形成饱和溶液(AgCl固体有剩余),下列说法正确的是?(?)
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.在此饱和溶液中加水,KSP(AgCl)增大
C.在此饱和溶液中加浓的Na2S溶液,生成黑色沉淀
D.向AgCl饱和溶液中加入NaCl固体,c(Ag+)不变
参考答案:AC
本题解析:A正确,AgCl固体溶解在水中存在沉淀溶解平衡,属于动态平衡,当达到溶解平衡后,沉淀的溶解速率与沉淀的生成速率相等,但不为0。
B错,沉淀溶解平衡的平衡常数即溶度积只受温度影响,与其他因素无关;
C正确,Ag2S的溶解度小于AgCl的溶解度,所以,当向饱和的AgCl溶液中加入Na2S溶液会生成Ag2S黑色沉淀。
D错,KSP(AgCl)=c(Ag+)×c(CL—),只要温度不变,KSP(AgCl)为一常数,当加入NaCl固体后,溶液中c(CL—)增大,即c(Ag+)浓度减小。
本题难度:一般
5、填空题 (1)100℃时纯水Kw=1×10-12?mol2?L-2在该温度下,将1mL?0.001mol?L-1的NaOH溶液的pH为______,若加水稀释至100L,则溶液的pH为______.
(2)室温下,pH=1的稀硫酸a?L与pH=12的苛性钠b?L混合后溶液的pH=2,忽略溶液混合前后体积变化,则a:b=______.
(3)已知25℃时100g水中溶有0.74g的Ca(OH)2即达到饱和,则该条件下Ca(OH)2离子积为Ksp=______.
参考答案:(1)1mL?0.001mol?L-1的NaOH溶液的c(OH-)=c(NaOH)=1×10-3mol/L,所以c(H+)=10-121×10-3mol/L═1×10-9mol/L,所以该溶液的pH=-lg(1×10-9)=9,将1mL?0.001mol?L-1的NaOH溶液,加水稀释至100L,NaOH溶液的c(OH-)≈1×10-6mol/L,所以该溶液的pH=-lg(1×10-6)=6,略呈碱性,接近中性,
故答案为:9; 6;
(2)室温下,pH=1的稀硫酸c(H+)=0.1mol/L,pH=12的苛性钠c(OH-)=c(NaOH)=0.01mol/L,要使得混合后溶液pH=2,则混合后0.1a-0.01ba+b=0.01mol/L,则ab=2:9,
故答案为:2:9;
(3)25℃时100g水中溶有0.74g的Ca(OH)2即达到饱和,则该条件下100克水中溶解0.74克Ca(OH)2,物质的量为0.01mol,此时溶液质量:100.74克,溶液体积:100.74g÷1g/cm3=100.74mL,此时Ca(OH)2物质的量浓度为:C=nV=0.01mol0.10074L=0.099mol/L,所以,此时Ca2+物质的量浓度为:0.099mol/L,OH-物质的量浓度为:0.198mol/L,Ksp=c(Ca2+)×c(OH-)2=0.004 mol3?L-3,
故答案为:0.004 mol3?L-3;
本题解析:
本题难度:一般