时间:2017-03-02 22:49:18
1、填空题 Li2MSiO4(M=Mn、Fe、Co等)是极具发展前景的新型锂离子电池的电极材料,下面列出了两种制备
Li2FeSiO4的方法。同相法:2Li2SiO3+FeSO4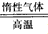 Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
溶胶一凝胶法: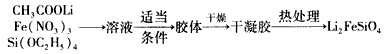
(1)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是___________________。
(2)溶胶一凝胶法中,检验溶液中有胶体产生的方法是_________________实验中若制得1mol Li2FeSiO4,整个反应过程中转移电子的数目为__________。
(3)以Li2FeSiO4、嵌有Li的石墨为电极,含Li+的导电固体为电解质的锂离子电池,充、放电的总反应式可表示为Li2FeSiO4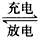 Li+LiFeSiO4,该电池放电时的正极反应式为____________________。
Li+LiFeSiO4,该电池放电时的正极反应式为____________________。
(4)Li2MSiO4的性能对比如下图所示。实际应用时,常用含有来源丰富的铁元素的Li2FeSiO4作电极材料,使用该电极材料的另一个优点是______________。 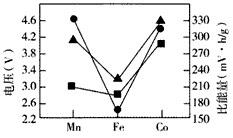
▲Li2MSiO4充电时脱去Li+所需电压 ●Li2MSiO4放电时的理论电压 ●Li2MSiO4放电时的理论比能量
2、选择题 下列物质的制备,符合工业生产实际的是
[? ]
A.将氯气通入澄清石灰水中制漂白粉
B.用离子交换膜法电解饱和食盐水制备烧碱、氢气和氯气
C.将氢气和氯气混合后点燃,产物用水吸收制备盐酸
D.将SO2和O2的混合气加高压后,通过接触室,制备SO3
3、填空题 高铁酸钾是一种高效多功能水处理剂。工业上常采用NaClO氧化法生产,反应原理为:
①?在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4。3NaClO?+?2Fe(NO3)3?+?10NaOH=2Na2FeO4↓+?3NaCl?+?6NaNO3?+?5H2O?
②?Na2FeO4与KOH反应生成K2FeO4:Na2FeO4?+?2KOH=K2FeO4?+?2NaOH 主要的生产流程如下: 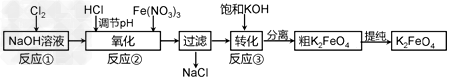
(1)写出反应①的离子方程式_________________
(2)流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)
_______Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。 图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响; 图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。 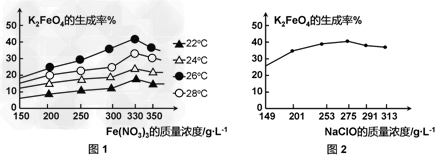
①?工业生产中最佳温度为_______?℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为___________。
②?若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式_________________
(4)K2FeO4在水溶液中易水解:4FeO42-?+?10H2O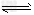 4Fe(OH)3?+?8OH-?+?3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用________溶液(填序号)。
4Fe(OH)3?+?8OH-?+?3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用________溶液(填序号)。
A.H2O? B.CH3COONa、异丙醇 C.NH4Cl、异丙醇? D.Fe(NO3)3、异丙醇
4、选择题 我国西气东输工程可大大缓解东部能源的短缺,同时也有利于加快西部经济开发.下列关于天然气的叙述中,正确的是( )
A.天然气是最理想的洁净能源
B.燃烧天然气比较清洁,产生的有害废气比燃烧氢气少
C.天然气、沼气的主要成分都是CH4
D.用天然气作燃料可解决全球性温室效应问题
5、填空题 工业上用铜屑和浓硝酸为原料制取硝酸铜。在实际生产中,需把浓硝酸用等体积的水稀释。试简要回答下列问题:
(1)用稀硝酸而不用浓硝酸的原因是___
(2)从经济效益和环境保护角度考虑,设计制取硝酸铜最适宜的方法,用化学方程式表示为____