时间:2017-03-02 22:47:59
1、选择题 25℃ 时,水的离子积为Kw,该温度下将 a mol ·L-1一元酸 HA 与b mol·L-1一元强碱BOH 等体积混合,若恰好完全反应,下列结论中不正确的是
A. 混合液中:c(H+ ) ≤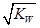 B. 混合液中:c(HA)+c(A-)=a mol·L-1
B. 混合液中:c(HA)+c(A-)=a mol·L-1
C. a = b D. 混合液中:c(H+)+c(B+)= c(OH-)+c(A-)
参考答案:B
本题解析: HA 与BOH 等体积混合,恰好完全反应:HA+BOH==BA+H2O,酸和碱的物质的量相同,故C正确;根据电荷守恒,D正确;若HA为强酸,反应后的盐溶液为中性,c(H+)=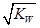 ;若HA为若酸,反应后的盐溶液为碱性,c(H+)<
;若HA为若酸,反应后的盐溶液为碱性,c(H+)<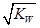 ,A正确;若HA为强酸,反应后的盐溶液为中性,c(A-)=1/2a mol·L-1;若HA为若酸,反应后的盐溶液为碱性,c(HA)+c(A-)=1/2a mol·L-1,B不正确;
,A正确;若HA为强酸,反应后的盐溶液为中性,c(A-)=1/2a mol·L-1;若HA为若酸,反应后的盐溶液为碱性,c(HA)+c(A-)=1/2a mol·L-1,B不正确;
考点:酸碱混合后的离子问题。
本题难度:困难
2、选择题 关于溶液中微粒的浓度,下列说法正确的是
A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-)
B.等浓度等体积的NaHSO3溶液与NaClO溶液混合后:c(Na+) + c(H+) = c(HSO3-) + c(ClO-) + c(SO32-) + c(OH-)
C.等浓度等体积的NaHCO3溶液与NaCl溶液混合后:1/2 c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3)
D.标况下,将2.24L SO2气体通入到100ml 1mol·L-1的NaOH溶液中,完全反应后溶液呈酸性,则该溶液中:c(Na+) > c(HSO3-) > c(SO32-) >c(H+) > c(OH-)
参考答案:C
本题解析:A、(NH4)2SO4溶液中,NH4+水解程度较低,溶液呈酸性,离子的物质的量浓度关系为:c(NH4+) > c(SO42-)>c(H+)>c(OH-),错误;B、等浓度等体积的NaHSO3溶液与NaClO溶液混合后根据电荷守恒:c(Na+) + c(H+) = c(HSO3-) + c(ClO-) + 2c(SO32-) + c(OH-),错误。C、根据物料守恒可得1/2 c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3),正确;D、二者反应的化学方程式为:SO2+NaOH=NaHSO3,则该溶液中:c(Na+) > c(HSO3-) >c(H+) > c(SO32-) > c(OH-),错误。
考点:考查离子浓度大小比较。
本题难度:困难
3、选择题 下列物质的水溶液,其pH小于7的是
A.Na2CO3
B.NH4NO3
C.Na2SO4
D.KNO3
参考答案:B
本题解析:Na2CO3是强碱弱酸盐,水解显碱性,NH4NO3强酸弱碱盐水解溶液显酸性; Na2SO4强酸强碱盐,不水解,溶液显中性,KNO3强酸强碱盐,不水解,溶液显中性,,选B。
考点:盐类水解和溶液酸碱性。
本题难度:一般
4、实验题 (12分)硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:
已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
参考答案:(1)Fe2+、Fe3+、Al3+;(2)将溶液中Fe3+还原为Fe2+,便于与Al3+分离;5(4.7~7.6或其之间的任意数值);(3)Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;(NH4)2SO4;(4)FeCO3+O2 2Fe2O3+4CO2
2Fe2O3+4CO2
本题解析:在硫铁矿烧渣中含有Fe2O3、Fe3O4,以及少量SiO2、Al2O3等,当加入酸时,Fe2O3、Fe3O4、Al2O3发生反应变为Fe2+、Fe3+、Al3+存在于溶液中;而SiO2不能溶解在酸中,被过滤除去;(2)由于Fe3+、Al3+形成沉淀时的溶液的pH接近,不容易分离,所以加入Fe粉除调pH外,另一个作用是将溶液中Fe3+还原为Fe2+,便于与Al3+分离;由于Al3+沉淀完全的溶液的pH=4.7,而Fe2+沉淀完全的溶液的pH=9.7,所以Fe粉调节溶液的pH为4.7~7.6或其之间的任意数值;(3)根据题意在“沉淀、过滤”步骤中生成FeCO3的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;由于在过程中加入的是硫酸和NH4HCO3,所以所得滤液的主要溶质是(NH4)2SO4;(4)高温条件下,FeCO3和O2发生反应产生Fe2O3和CO2,根据电子守恒和元素的原子个数守恒可得该“氧化”步骤中发生反应的化学方程式为FeCO3+O2 2Fe2O3+4CO2。
2Fe2O3+4CO2。
考点:考查物质的性质、转化、反应条件的控制与选择、方程式的书写的知识。
本题难度:困难
5、选择题 常温下将0.01mol·L-1NaOH溶液与0.01mol·L-1CH3COOH溶液混合,不可能出现的结果是
A.pH>7,且c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.pH<7,且c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
参考答案:A
本题解析:
本题难度:简单