时间:2017-03-02 22:46:00
1、填空题 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g)? △H1 = -90.1kJ?mol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)? △H2?= -49.0kJ?mol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g)? △H3?= -41.1kJ?mol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g)? △H4?= -24.5kJ?mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是?(以化学方程式表示)。
(2)分析二甲醚合成反应(iV)对于CO转化率的影响?。
(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为?。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响?。
(4)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是?。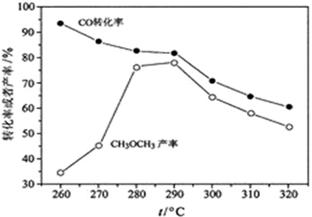
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93kW?h?kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为?,一个二甲醚分子经过电化学氧化,可以产生?个电子的能量;该电池的理论输出电压为1.20V,能量密度E = ?(列式计算。能量密度=电池输出电能/燃料质量,1 kW?h = 3.6×106J)。
参考答案:
(1)Al2O3(铝土矿) + 2NaOH + 3H2O = 2NaAl(OH)4
NaAl(OH)4 + CO2?= Al(OH)3↓ + NaHCO3,2Al(OH)3 Al2O3+ 3H2O
Al2O3+ 3H2O
(2)消耗甲醇,促进甲醇合成反应(i)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(iii)消耗部分CO。
(3)2CO(g) + 4H2(g) = CH3OCH3 + H2O(g)? △H?= -204.7kJ?mol-1?
该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加。压强升高使CO和H2浓度增加,反应速率增大。
(4)反应放热,温度升高,平衡左移。
(5)CH3OCH3 + 3H2O = 2CO2 + 12H+ + 12e-? 12 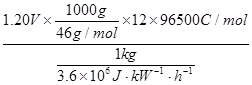 =8.39kW·h·kg-1
=8.39kW·h·kg-1
本题解析:
(1)从铝土矿制备较高纯度Al2O3的主要工艺流程:铝土矿用氢氧化钠溶液溶解,Al2O3+ 2NaOH + 3H2O = 2NaAl(OH)4,铝元素在溶液中以NaAl(OH)4存在,在溶液中通入二氧化碳气体进行酸化,NaAl(OH)4 + CO2?= Al(OH)3↓ + NaHCO3,过滤得到Al(OH)3沉淀,高温煅烧,2Al(OH)3 Al2O3+ 3H2O,得到较高纯度Al2O3。
Al2O3+ 3H2O,得到较高纯度Al2O3。
(2)根据四个反应方程式可知:二甲醚合成反应(iV)中消耗甲醇,促进甲醇合成反应(i)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(iii)消耗部分CO。
(3)根据题目所给条件和盖斯定律,由H2和CO直接制备二甲醚的热化学方程式为2CO(g) + 4H2(g) = CH3OCH3 + H2O(g)? △H?= -204.7kJ?mol-1。该反应为分子数减少的反应,增加压强使平衡右移,CO和H2转化率均增大,CH3OCH3产率增加。增加压强使CO和H2浓度增加,反应速率增大。
(4)由H2和CO直接制备二甲醚,由于该反应是放热反应,随温度升高,平衡逆向移动,CO转化率随温度升高而降低。
(5)根据反应产物,二甲醚直接燃料电池的负极反应为CH3OCH3+3H2O-12e-=
2CO2+12H+,根据方程式可知:一个二甲醚分子经过电化学氧化,可以产生12个电子的能量;根据能量密度的计算公式,E = 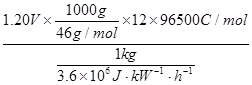 =8.39kW·h·kg-1。
=8.39kW·h·kg-1。
【考点定位】反应速率、化学平衡、电化学、化学计算
本题难度:一般
2、选择题 在一个不导热的恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g) CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是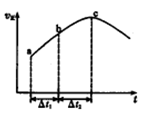
A.反应物浓度:a点小于c点
B.c点时反应进行的程度最大
C.该反应的正反应为吸热反应
D.△t1=△t2时,生成H2的物质的量:a~b段小于b~c段
参考答案:D
本题解析:反应起始时反应物浓度大,因此反应物浓度:a点大于c点,A项错;c点反应速率最大,反应不一定处于平衡态,而反应进行程度最大是指反应达到平衡态,B项错;反应起始阶段,反应物浓度减少而反应速率加快,只能是温度升高导致,再结合容器不导热可知正反应为放热反应,C项错;反应速率a~b小于b~c,故等同时间内,生成H2的量,a~b段小于b~c段,D项正确。
本题难度:一般
3、选择题 在一定条件下,对于密闭容器中进行的可逆反应:2SO2(g)+O2(g)
?2SO3(g).下列说法中,表明这一反应已经达到化学平衡状态的是( )
A.SO2、O2、SO3的浓度不再变化
B.SO2、O2、SO3的浓度相等
C.正、逆反应速率都等于零
D.SO2、O2、SO3在密闭容器中共存
参考答案:A、达到平衡时,正逆反应速率相等,各种物质的浓度不再发生变化,故A正确;
B、反应平衡时各物质的浓度是否相等取决于起始时各物质的量的关系和转化的程度,不能作为判断是否达到平衡的依据,故B错误;
C、反应达到平衡时,正逆反应速率相等,但反应并没有停止,故C错误.
D、该反应为可逆反应,无论是否达到平衡状态,各种物质都共存,故D错误;
故选A.
本题解析:
本题难度:一般
4、选择题 一定温度下,在一定容的密闭容器中充入NO2发生如下反应:2NO2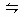 N2O4并达到平衡,此时NO2的转化率为P%,再次充入NO2,其转化率将(?)
N2O4并达到平衡,此时NO2的转化率为P%,再次充入NO2,其转化率将(?)
A.增大
B.减小
C.不变
D.无法确定
参考答案:A
本题解析:】将继续充入的NO2在另一个容器中建立与原平衡相等条件的等效平衡后,再将其和原平衡压缩在一起建立平衡。由此可见,充入NO2相当于增大原平衡的压强,NO2的转化率增大。
本题难度:一般
5、填空题 (6分)用注射器吸入少量NO2和N2O4的混合气体,发生如下反应(如图2—13所示)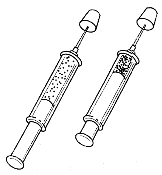
图2—13
2NO2(g) N2O4(g)
N2O4(g)
(1)当活塞迅速向外拉时,气体的颜色先变_________,后变_________;最终和最初相比,_________更深。
(2)当活塞迅速向里推时,气体的颜色先变_________,后变_________;最终和最初相比,_________更深。
参考答案:(1)浅?深?最初? (2)深?浅?最终
本题解析:(极限思维法)(1)迅速向外拉的瞬间,平衡尚未发生移动,这时单位体积内的NO2分子数目减小,所以气体颜色变浅;容积扩大,气体压强减小,平衡向逆反应方向(生成NO2的方向)移动,单位体积内的NO2分子数增多,气体颜色变深;这时容器内NO2分子总数虽多,但浓度不及初始时大,故颜色不及初始时深。
(2)迅速向里推的瞬间,平衡尚未发生移动,这时,单位体积内的NO2分子数目增多,气体颜色变深;容积变小,气体压强增大,平衡向正反应方向(生成N2O4的方向)移动,NO2分子数目减少,气体颜色变浅,但比初始时要深。
本题难度:简单