时间:2017-03-02 22:46:00
1、填空题 氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:3SiO2(s) + 6C(s) + 2N2(g) Si3N4(s) + 6CO(g) + Q(Q>0)
Si3N4(s) + 6CO(g) + Q(Q>0)
完成下列填空:
(1)某温度下该反应在一容积为2L的密闭容器中进行,2min后达到平衡,刚好有2mol电子发生转移,则2min内反应的速率为:v(CO) = ?;该反应的平衡常数表达式为 ?。
(2)其它条件不变时仅增大压强,则?。
a.K值减小,平衡向逆反应方向移动?
b.K值增大,平衡向正反应方向移动
c.K值不变,平衡向逆反应方向移动?
d.K值不变,平衡向正反应方向移动
(3)一定条件下能说明上述反应已达平衡的是 ?。
a.c(N2 ) : c(CO) = 1:3? b.3v(N2 ) = v(CO)
c.固体质量不再改变? d.气体密度不再改变
达到平衡后改变某一条件,反应速率v与时间t的关系如图所示。?
若不改变N2与CO的量,则图中t4时引起变化的原因可能是 ?;图中t6时引起变化的原因可能是?。
由图可知,平衡混合物中CO含量最高的时间段是?。
参考答案:(1)0.25mol/L·min(1分,计算或单位错不给分);?K=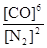 (1分)(2)c?(1分)
(1分)(2)c?(1分)
(3)c、d(1分×2)33、升高温度或缩小体积(增大压强)(1分);加入了催化剂(1分)。
t3~t4(1分)。
本题解析:(1)可逆反应3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)的平衡常数k=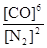 该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;(2)由方程式可知,该反应正反应是气体物质的量增大的反应,混乱度增大,熵值增大,故△S>0;故答案为:>;(3)A.单位时间生成2摩尔Si3N4的同时生成1摩尔的N2,生成2摩尔Si3N4的消耗4molN2,氮气的生成速率与消耗速率不相等,反应未达平衡状态,故A错误;B.平衡时c(N2)与c(CO)之比为1:3,可能处于平衡状态,也可能不处于平衡状态,与氮气的转化率等有关,故B错误;C.平衡时平衡体系个组分的含量不变,CO的百分含量保持不变,说明到达平衡状态,故C正确;D.单位时间消耗1摩尔SiO2的同时生成2摩尔的C,消耗1摩尔SiO2需要消耗2molC,C的生成速率与消耗速率相等,反应达平衡状态,故D正确;故选CD;(4)若不改变N2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为升高温度后压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂;t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;故答案为:升高温度后压缩体积增大压强;加入催化剂;t3~t4。
该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;(2)由方程式可知,该反应正反应是气体物质的量增大的反应,混乱度增大,熵值增大,故△S>0;故答案为:>;(3)A.单位时间生成2摩尔Si3N4的同时生成1摩尔的N2,生成2摩尔Si3N4的消耗4molN2,氮气的生成速率与消耗速率不相等,反应未达平衡状态,故A错误;B.平衡时c(N2)与c(CO)之比为1:3,可能处于平衡状态,也可能不处于平衡状态,与氮气的转化率等有关,故B错误;C.平衡时平衡体系个组分的含量不变,CO的百分含量保持不变,说明到达平衡状态,故C正确;D.单位时间消耗1摩尔SiO2的同时生成2摩尔的C,消耗1摩尔SiO2需要消耗2molC,C的生成速率与消耗速率相等,反应达平衡状态,故D正确;故选CD;(4)若不改变N2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为升高温度后压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂;t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;故答案为:升高温度后压缩体积增大压强;加入催化剂;t3~t4。
本题难度:困难
2、填空题 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)="2NO(g)" △H=+180.5 kJ/mol?
2C(s)+ O2(g)="2CO(g)" △H="-221.0" kJ/mol
C(s)+ O2(g)=CO2(g) △H="-393.5" kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)?△H=?。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表: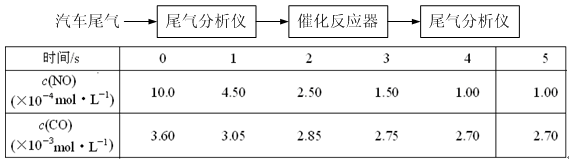
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v (N2) = ___________________。
②在该温度下,反应的平衡常数K =?。(只写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明?(填字母)。
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是?。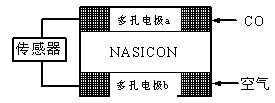
A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
参考答案:(1)-746.5 kJ/mol(2)①1.88×10-4 mol/(L·s) 5000?③BCD?(3)B
本题解析:略
本题难度:简单
3、填空题 (12分)一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
发生如下反应:CO (g) 十H2O (g)  ?CO2 (g) 十 H2 (g) ; △H<0
?CO2 (g) 十 H2 (g) ; △H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO2)=?_mol·L-1·min-1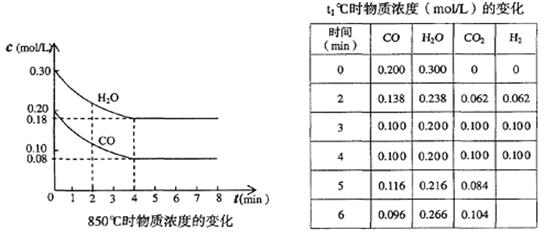
(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如右上表:
① 计算t1℃该反应的平衡常数为K = ?。
② t1℃时,反应在5min~6min间,平衡?移动(填向左、向右或不 ),若在第5分钟改变一种条件达到第6分钟的浓度,改变的条件是?________。
(3)t2℃时,化学反应CO (g) + H2O (g)  ?CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃?850℃,判断依据是:??
?CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃?850℃,判断依据是:??
参考答案:(1)0.03 ?(2)① 0.5? ② 向右;?将H2O (g)浓度增加到0.286 mol·L-1(写增加H2O (g)浓度得1分) (3)< ;? t2℃的平衡常数为2,大于850℃的平衡常数1,平衡右移
本题解析:(1)反应速率通常用单位时间内浓度的变化量来表示。根据图像可知,在0~4min内CO的浓度变化量是0.20mol/L-0.08mol/L=0.12mol/L,根据方程式可知CO2的浓度变化量也是0.12mol/L,所以反应速率是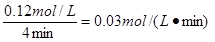 。
。
(2)①根据表中数据可知反应进行到3min时,物质的浓度就不再发生变化,反应达到平衡状态。所以平衡常数为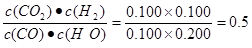 .
.
②反应在5min~6min间时,反应物的浓度降低,生成物的浓度增大,说明平衡向正反应方向移动。由于在第6min时CO的浓度减小,H2O的浓度增大,CO2的浓度也增大,说明改变的条件是增大了水蒸气的浓度,根据CO的变化量可知,在第5min时将H2O (g)浓度增加到0.266mol/L+0.116mol/L-0.096mol/L=0.286 mol·L-1。
(3)平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则此时平衡常数为2,根据(1)可计算出850℃时的平衡常数为1,即此时大于850℃的平衡常数,说明反应向正反应方向移动。又因为反应是放热反应,所以温度降低才能向正反应方向移动。
本题难度:一般
4、填空题 2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:
A(g)+2B(g)?C(g)+D(g),
在不同温度下,D的物质的量n(D)和时间t的关系如图
试回答下列问题:
(1)800℃时.0-5min内,以B表示的平均反应速率为______.
(2)能判断该反应达到化学平衡状态的标志是______.
A.容器压强不变B.混合气体中c(A)不变
C.2v正(B)=v逆(D)D.c(A)=c(C)
E.混合气体的平均分子量不再改变F.混合气体密度不变
G.A:B:C:D=1:2:1:1
(3)利用图中数据计算800℃时的平衡常数K=______,B的平衡转化率为:______.
该反应为______反应(填吸热或放热).
(4)800℃时,另一2L容积不变的密闭容器中,测得某时刻各物质的量如下:
n(A)=2.2mol,n(B)=5.2mol,n(C)=1.8mol,n(D)=1.8mol,则此时该反应______进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”).
参考答案:(1)800℃时.0-5min内,D的平均化学反应速率v(D)=△nV△t=0.6mol2L5min=0.06mol/Lmin,同一反应中,各物质的反应速率之比等于计量数之比,所以v(B):v(D)=2:1=v(B):0.06mol/Lmin,v(B)=0.12mol?L-1?min-1;
故答案为:0.12mol?L-1?min-1;
(2)该反应是反应前后气体体积减小的反应,反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
A:该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故A正确.
B、反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,故B正确;
C、2v正(B)=v逆(D),速率之比不等于化学计量数之比,反应未达平衡状态,故C错误.
D、无论反应是否达到平衡状态,c(A)=c(C),所以不能作为判断平衡状态的依据,故D错误.
E、反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量不变,混合物的质量不变,所以混合气体的平均分子量不再改变,所以能作为化学平衡状态的判断依据,故E正确.
F、根据质量守恒,无论反应是否达平衡状态,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故F错误.
G、反应按照n(A):n(B):n(C):n(D)=1:2:1:1进行,开始n(A):n(B)不是1:2;到达平衡后,n(A):n(B):n(C):n(D)一定不是1:2:1:1,故G错误.
故答案为:ABE
(3)A(g)+2B(g) C(g)+D(g),
C(g)+D(g),
起始 1.0mol 2.2mol 0 0
反应0.6mol1.2mol 0.6mol0.6mol
平衡0.4mol 1.0mol 0.6mol0.6mol
平衡时A、B、C、D各物质的浓度分别为0.2mol/L、0.5mol/L、0.3mol/L、0.3mol/l、
化学平衡常数K=0.3mol/L×0.3mol/L0.2mol/L×(0.5mol/L)2=1.8(mol?L-1)-1;
B的平衡转化率=1.2mol2.2mol×100%=54.5%;
根据图象知,降低温度,D的含量减少,所以平衡向逆反应方向移动,故正反应是吸热反应.
故答案为:1.8(mol?L-1)-1;54.5%;吸热.
(4)A、B、C、D各物质的浓度分别为1.1 mol/L、2.6 mol/L、0.9 mol/L、0.9 mol/L
浓度商QC=0.9mol/L×0.9mol/L1.1mol/L×(2.6mol/L)2=0.11(mol?L-1)-1<1.8(mol?L-1)-1,所以反应向正反应方向进行.
故答案为:向正反应方向.
本题解析:
本题难度:一般
5、计算题 (6分)如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2? mol Y,起始时,v(A)=v(B)="a" L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X+Y 2Z+W;(X、Y、Z、W均为气体)正反应为放热反应,达到平衡时,v(A)="1.2a" L。
2Z+W;(X、Y、Z、W均为气体)正反应为放热反应,达到平衡时,v(A)="1.2a" L。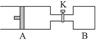
试回答:
(1)A中X的转化率α(A)_______________________________________________________。
(2)A、B中X的转化率的关系:α(A) ___________α(B)。(填“<”“>”或“=”)
(3)打开K,一段时间又达到平衡,A的体积为___________L。(连通管中气体体积不计)
参考答案:(1)40%? (2)>? (3)2-6a
本题解析:X+Y 2Z+W? ΔV
2Z+W? ΔV
1? 1 ?2? 1? 1
反应? 0.2a? 0.2a
反应前X的体积为0.5a,反应掉0.2a,则α(A)=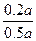 ×100%=40%。
×100%=40%。
A相对于B压强减小,平衡右移α(A)>α(B)。
本题难度:简单