时间:2017-03-02 22:45:21
1、实验题 CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。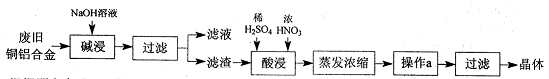
根据题意完成下列填空:
(1)“碱浸”的目的是?,写出有关的离子方程式?。
(2)向滤渣中先加入足量稀硫酸,然后再滴加少量浓硝酸,在废渣溶解时可以观察到的实验现象有?。
(3)操作a的名称为?,制得的CuSO4·5H2O中可能存在硝酸铜杂质,除去这种杂质的实验操作名称为?。
(4)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4。称取0.26 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸8.00 mL,则该试样中CuSO4·5H2O的质量分数为?;上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用?。
(5)在“酸浸”的步骤中,①若只加入浓硫酸,写出加热时的化学方程式?。
②若将浓硝酸换成过氧化氢,常温时即可生成硫酸铜,指出此种方法的优点?。
参考答案:
(1)溶解金属铝、除去油污? 2Al+2H2O+2OH-=2AlO2-+3H2↑
(2)金属溶解,溶液变蓝,有无色气体产生且在溶液上方变为红棕色
(3)冷却结晶?重结晶
(4)0.92?用标准盐酸润洗2~3次
(5)Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O
本题解析:(1)实验目的是利用废旧铝铜合金制备硫酸铜晶体,故应先除杂。碱浸即是除杂过程,除去表面的油污和溶解金属铝,离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑;(2)加入少量浓硝酸后稀释,与铜反应,生成硫酸铜和NO气体,故现象为铜溶解,溶液变为蓝色,有无色气体产生并只溶液上方变为红棕色(变成NO2);(3)采用冷却结晶的方法分理出硫酸铜晶体,除去晶体中的可溶性杂质的方法是重结晶;
(4)与CuSO4的氢氧化钠的量n(NaOH)=28.00×0.1000×10-3-8.00×0.1000×10-3=2×10-3mol
n(CuSO4·5H2O) = n(NaOH)/2=10-3mol? w(CuSO4·5H2O)=10-3×250÷0.26=0.92
(5)过氧化氢是一种绿色氧化剂,相对浓硝酸而言不产生污染性气体,不产生杂质
本题难度:一般
2、选择题 化学实验中的安全意识是重要的科学素养。下列操作或事故处理不正确的是(?)
A.用钢瓶储运干燥的液氧
B.将酒精灯熄灭后,再向其中补充酒精至适量
C.用氢气还原氧化铜时,应先加热氧化铜,再通氢气
D.钾钠着火时,应立即以沙子扑灭
参考答案:C
本题解析:氢气还原氧化铜,应先通一会氢气再加热,避免H2和空气中O2发生爆炸
本题难度:简单
3、实验题 实验室配制500 mL 0.1 mol·L-1的Na2CO3溶液,请回答下列问题。
(1)应用托盘天平称取Na2CO3·10H2O晶体?g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1 g以下用游码),天平平衡时,则实际称量的Na2CO3·10H2O晶体?g。
(3)用托盘天平和小烧杯称出Na2CO3·10H2O的质量,其正确操作顺序的标号为(操作可以重复)_______________。
A.调整零点
B.将游码移至刻度尺的零刻度处,将砝码放回砝码盒内
C.将碳酸钠晶体放入小烧杯中称量
D.称量空的小烧杯
E.记录称量结果
(4)下列操作对配得的溶液无影响的是?(填序号);会使所配溶液浓度偏大的是?(填序号)。
①在烧杯内溶解溶质,搅拌时不慎溅出少量溶液。
②容量瓶未烘干就用来配制溶液。
③定容时俯视刻度线。
④定容时仰视刻度线。
⑤定容时不小心使少量蒸馏水流出瓶外。
⑥将所配溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出。
参考答案:(1)14.3g。? (2)13.7g。? (3)ADECEB? (4)2.5.6(填序号);3(填序号)
本题解析:考查一定物质的量浓度溶液的配制及有关误差分析。
(1)500 mL 0.1 mol·L-1的Na2CO3溶液中碳酸钠的物质的量是0.05mol,所以需要Na2CO3·10H2O晶体的质量是0.05mol×286g/mol=14.3g。
(2)由于托盘天平中,左盘的质量总是等于右盘的质量和游码的质量之和,所以当药品放在天平右盘上,砝码放在天平左盘上时,物体的实际质量是14.0g-0.3g=13.7g。
(3)根据配制的原理及要求可知,正确的操作顺序是ADECEB。
(4)根据c=b/V可知,如果在烧杯内溶解溶质,搅拌时不慎溅出少量溶液,则溶质减少,浓度偏小;容量瓶不需要烘干,因此选项②无影响;定容时俯视刻度线,则容量瓶中溶液的体积减少,浓度偏高;定容时仰视刻度线,则容量瓶中溶液的体积增加,浓度偏小;定容时不小心使少量蒸馏水流出瓶外,对实验结果不影响;同样将所配溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出时,也不会影响实验结果。
本题难度:一般
4、实验题 右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。
现用该浓硫酸配制100 mL 1 mol·L-1的稀硫 酸。
酸。
可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④?药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的?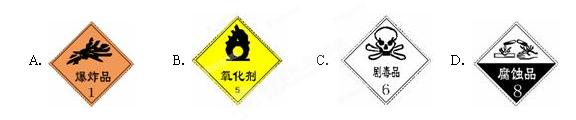 ?
?
(2)配制稀硫酸时,还缺少的仪器有?(写仪器名称);
(3)经计算,配制100 mL1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为?mL,量取硫酸时应选用?mL规格的量筒;
A.10 mL? B.50 mL ?C.100 mL? D.200mL
(4)在烧杯中稀释浓硫酸的实验操作为?
若在稀释过程中,少量浓硫酸不慎沾在手上,处理方法为?
(5)对所配制的 稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因?。
稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因?。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸?
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.定容时,俯视容量瓶刻度线进行定容
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
参考答案:(1)D(1分)? (2)玻璃棒、100mL的容量瓶(各1分)? (3)5.4(2分)? A(1分)?
(4)将浓硫酸沿烧杯壁缓缓注入装有水的烧杯中,并用玻璃棒不断搅拌,使产生的热迅速散去(1分)?立即用大量水冲洗,可以涂上NaHCO3的稀溶液(1分)? (5)ACE(2分)
本题解析:略
本题难度:简单
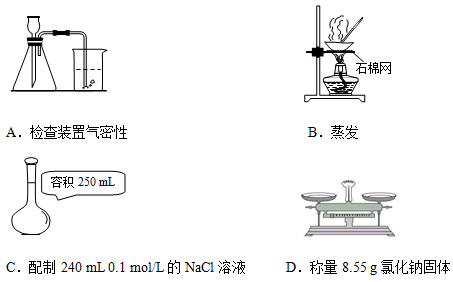
5、选择题 正确的实验操作是实验成功的基本保证。下列实验操作正确的是
_
参考答案:C
本题解析:A项检验气密性的装置要区别分液漏斗和长颈漏斗:分液漏斗用此装置,长颈漏斗右端不能插入水中,最好用止水夹夹住橡皮管,向长颈漏斗中加水至水柱不再下降,观察一段时间即可;B项蒸发皿不能放在石棉网上,直接在酒精灯上加热即可;C项正确;D项托盘天平只能读数到0.1g,读不到0.01g。
点评:本题涉及知识比较多,综合性较强,尤其气密性检验是学生掌握的难点,属于较难的习题。
本题难度:一般