时间:2017-03-02 22:40:24
1、选择题 能把Na2SO3、Na2SO4、Na2SiO3三种无色溶液区分开的一种试剂是( )
A.Ba(OH)2溶液
B.紫色石蕊试液
C.CaCl2溶液
D.盐酸
2、实验题 Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响。实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。 
(2)实验测得p-CP的浓度随时间变化的关系如下图所示。 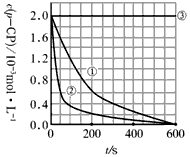
a.请根据上图实验①曲线,计算降解反应在50-300s内的平均反应速率v(p-CP) =__________,以及300s时p-CP的降解率_____________。
b.实验①②表明温度升高,降解反应速率__________。
c.实验③得出的结论是:pH=10时,______________________。
(3)可通过反应Fe3++SCN-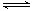 Fe(SCN)2+来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)=0.04mol·L-1,c(SCN-)=0.1mol·L-1,c[Fe(SCN)2+]=0.68mol·L-1。则此温度下该反应的平衡常数K=_________。
Fe(SCN)2+来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)=0.04mol·L-1,c(SCN-)=0.1mol·L-1,c[Fe(SCN)2+]=0.68mol·L-1。则此温度下该反应的平衡常数K=_________。
3、实验题 实验室利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4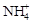 ?+ 6HCHO = 3H++ 6H2O + (CH2)6N4H+
?+ 6HCHO = 3H++ 6H2O + (CH2)6N4H+
然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行如下实验:
[滴定时,1 mol (CH2)6N4H+与1 mol H+相当]
步骤Ⅰ:称取样品1.500 g
步骤Ⅱ:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀
步骤Ⅲ:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次
步骤Ⅳ:实验数据记录
<若NaOH标准溶液的浓度为0.1010 mol/L>
| 滴定次数 | 待测液的体积(mL) | 标准溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
4、简答题 我国化工专家侯德榜发明的侯氏制碱法的化学原理是将二氧化碳通入氨水的氯化钠饱和溶液中,其化学反应方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(1)在实验室中利用上述原理从反应所得溶液中分离出碳酸氢钠晶体的实验操作称为______,该装置使用的玻璃仪器有玻璃棒、______、______.
(2)实验所得碳酸氢钠晶体中,可能含有的杂质离子有Cl-和NH4+,实验室鉴定Cl-所选用的试剂是______,所发生反应的离子方程式为:______;鉴定另一种杂质离子NH4+的实验检验方法是______.
(3)碳酸氢钠晶体受热分解可得到纯碱,其化学反应方程式为______.
5、填空题 (12分).现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而得到较为纯净的NaNO3。实验流程可用下图表示:
请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X:?,沉淀B:?。
(2)实验流程中加入过量的Na2CO3的目的是?。
(3)实验方案得到的溶液3中肯定含有?(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的?,请写出所发生反应的离子方程式_______________。