时间:2017-03-02 22:34:45
1、选择题 下列溶液加热蒸干后,能析出溶质固体的是( )
A.AlCl3
B.NH4HCO3
C.KHCO3
D.Fe2 (SO4) 3
参考答案:D
本题解析:铝离子会发生水解,生成了氯化氢,加热使得氯化氢挥发,促进了铝离子的水解,所以AlCl3溶液加热蒸干后,不能析出溶质固体,故A不能选;由于双水解的作用,NH4HCO3溶液加热蒸干后,不能析出溶质固体,故B不能选;KHCO3加热易分解,所以加热蒸干后,不能析出溶质固体,故C不能选;铁离子虽然能够水解,但是硫酸不易挥发,所以加热蒸干Fe2 (SO4) 3溶液,可以析出溶质固体,故D正确。
考点:盐类水解
点评:本题考查了盐类的水解,该考点是高考考查的重点和热点,本题难度适中。
本题难度:简单
2、选择题 下列有机物中,能发生消去反应生成2种烯烃,又能发生水解反应的是( )
A.1-溴丁烷
B.2-甲基-3-氯戊烷
C.2,2-二甲基-1-氯丁烷
D.1,3-二氯苯
参考答案:A、1-溴丁烷发生消去反应生成一种烯烃,为1-丁烯,1-溴丁烷能发生水解反应生成1-丁醇,故A错误;
B、2-甲基-3-氯戊烷发生消去反应生成两种烯烃,分别为2-甲基-2-戊烯,4-甲基-2-戊烯,2-甲基-3-氯戊烷能发生水解反应生成2-戊醇,故B正确;
C、2,2-二甲基-1-氯丁烷发生消去反应生成一种烯烃,为3,3-二甲基-1-丁烯,2,2-二甲基-1-氯丁烷能发生水解反应生成2,2-二甲基-1-丁醇,故C错误;
D、卤代芳香烃一般难以发生水解反应和消去反应,故D错误;
故选:B.
本题解析:
本题难度:一般
3、选择题 含有等物质的量的CH3COOH和CH3COONa的混合溶液中,下列说法正确的是
A.c(CH3COOH) + c(H+ )<c(OH-) + c(CH3COO-)
B.c(H+ ) + c(CH3COOH) = c(OH-) + c(CH3COO-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(Na+) = c(CH3COOH) + c(CH3COO-)
参考答案:A
本题解析:含有等物质的量的CH3COOH和CH3COONa的混合溶液中,醋酸的电离程度大于CH3COO-的水解程度,溶液显酸性,所以选项C不正确。根据电荷守恒可知c(H+ ) + c(Na+)= c(OH-) + c(CH3COO-),由于c(Na+)>c(CH3COOH),则c(CH3COOH) + c(H+ )<c(OH-) + c(CH3COO-),A正确,B不正确。根据物料守恒可知,2c(Na+)=c(CH3COOH) + c(CH3COO-),D不正确,答案选A。
考点:考查溶液中离子浓度大小比较
点评:该题是高考中的常见题型,属于中等难度试题的考查。该题的关键是得出溶液显酸性,然后再利用好电荷守恒、物料守恒以及质子守恒即可。这些守恒法做题时需要注意体会和总结。
本题难度:困难
4、填空题 (10分)(1)写出稀硫酸与硫代硫酸钠溶液混合的离子方程式
(2)向FeCl3稀溶液中滴加少量KSCN稀溶液,离子方程式为
(2)若再向其中滴加少量硫氰化铵或硫酸铁浓溶液,现象是
(3)实验室配制FeCl3溶液的方法是:
(4)滴有酚酞试液的Na2CO3溶液显_______色,若给溶液加热,溶液颜色会_________,其原因是_____________________________________________(用方程式结合必要的文字回答)
参考答案:(10分)(1)S2O32-+2H+=S↓+SO2↑+H2O (2分)
(2)Fe3++3SCN—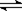 Fe(SCN)3 (2分) 红色溶液颜色加深(1分)
Fe(SCN)3 (2分) 红色溶液颜色加深(1分)
(3)把FeCl3固体溶解于浓盐酸,再加水稀释到所需浓度(1分)
(4)红色 红色加深(2分)
Na2CO3+H2O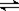 NaHCO3+NaOH 温度升高,平衡正向移动,c(OH-)增大(2分)(离子方程式也可)
NaHCO3+NaOH 温度升高,平衡正向移动,c(OH-)增大(2分)(离子方程式也可)
本题解析:略
本题难度:一般
5、选择题 某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是
A.溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.若溶液中部分粒子间满足:c(CH3COO-)=c(Na+)则该溶液一定呈中性
C.若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
参考答案:D
本题解析:A、若溶液中NaOH过量,且碱性较强,则可存在c(Na+)>c(OH-)>c(CH3COO-)>c(H+),正确;B、溶液中离子间满足:c(CH3COO-)=c(Na+),由电荷守恒可知,c(H+)=c(OH-),溶液为中性,正确;C、若溶液中溶质仅为CH3COONa ,则水解显碱性,应存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+),正确;D、若CH3COOH 较多,溶液可能呈酸性,可能满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),错误;选D。
考点:考查离子浓度的大小比较以及弱电解质的电离等知识。
本题难度:困难