时间:2017-03-02 22:24:09
1、选择题 下列有关化学键与晶体结构说法正确的是
A.两种元素组成的分子中所含化学键一定是极性键
B.金属晶体的熔点一定比分子晶体的高
C.某晶体中含有阳离子,则一定也含有阴离子
D.含有阴离子的化合物一定含有阳离子
参考答案:D
本题解析:A不正确,例如过氧化氢中含有非极性键;B不正确,例如金属汞的熔点就低于某些分子晶体的;C不正确,例如金属晶体中只有阳离子,没有阴离子,所以正确的答案选D。
本题难度:一般
2、实验题 (12分,本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分)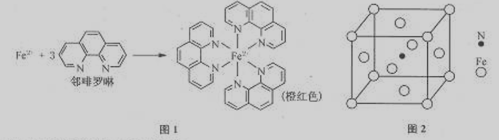
(1)Fe2+在基态时,核外电子排布式为?。
(2)羟胺(NH2OH)中采用sp3杂化的原子有?,羟胺熔沸点较高,是因为分子间存在较强的?。
(3)Fe2+与邻啡罗啉形成的配合物(形成过程如图1)中,配位数为?。
(4)根据价层互诉理论,C1O4—空间构形为?。
(5)铁能与氮形成一种磁性材料,其晶胞结构如图2,则该磁性材料的化学式为?。
B.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过取代反应(酯交换,生成新酯和新醇)得到,用菜籽油制备生物柴油的步骤如下:
①将三口烧瓶和锥形瓶做干燥处理,先向三口烧瓶中加入20g菜籽油,再称取40g正已烷(约61mL)。
②称取甲醇4.6g(约5.8mL)放到锥形瓶中,然后称取0.2g氢氧化钠固体并使之溶解,然后加到三口烧瓶中。
③如下图所示安装三口烧瓶。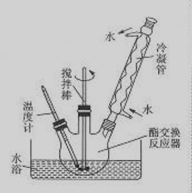
④恒温水浴加热,使温度保持在60—65℃左右,搅拌1.5—2h。
⑤停止加热后,冷却,取出三口烧瓶,静置、分液,上层
为生物紫油,正已烷和甲醇,下层主要为甘油。
⑥用温水洗涤制得的生物柴油3—4次。
⑦将水洗后的溶液倒入圆底烧瓶中,蒸馏,温度保持在
120℃左右,直至无液体蒸出后,烧瓶中剩余的液体主要即为
生物柴油。
(1)氢氧化钠的作用是?。
(2)正已烷的作用是?。
(3)图中冷凝管的作用是?。
(4)步骤⑤分液,用到的主要的一种玻璃仪器是?(写名称)
(5)确定步骤⑥已洗涤干净的方法是?。
(6)酸价(1g油酯的游离脂肪酸所需氢氧化钾的毫克数)的测定
a. 称取均匀试样Wg注入锥形瓶中,加入石油醚—乙醇混合液25mL,摇动锥形瓶使试样溶解。
b.滴入3滴酚酞,用0.100 mol/L KOH溶液滴定至出现微红色且保持30s不消失,消耗KOH溶液VmL。
则该生物柴油的酸价为?(用含W、V的代数式表示)
参考答案:
本题解析:略
本题难度:简单
3、选择题 下列化学名词正确的是( )
A.坩锅
B.烧碱
C.铵水
D.四氯化炭
参考答案:B
本题解析:
本题难度:简单
4、填空题 (15分)(物质结构与性质)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知 :
:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得: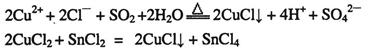
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子: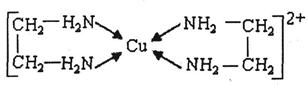
请回答下列问题:
(1)基态Cu原子的核外电子排布式为?。H、N、O三种元素的电负性由大到小的顺序是? ?。
?。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为
?。
(3)乙二胺分子 中氮原子轨道的杂化类型为?。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_?。
中氮原子轨道的杂化类型为?。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_?。
(4)②中所形成的配离子中含有的化学键类型有_______。(填字母)
a.配位键? b.极性键? c.离子键? d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_____。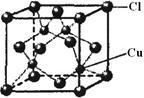
参考答案:
(3)sp3杂化(2分),乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键(2分)
( 4)abd(2分)?(5)4(2分)
4)abd(2分)?(5)4(2分)
本题解析:略
本题难度:一般
5、填空题 硫元素可以形成多种物质如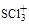 、SO2、SO32-、SO42-等。
、SO2、SO32-、SO42-等。
(1)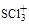 中S原子的轨道杂化类型是?,
中S原子的轨道杂化类型是?,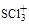 的空间构型是?。
的空间构型是?。
(2)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。分析表明该沉淀中Cu、S、N的物质的量之比为1:1:1,经测定该沉淀的晶体里有一种三角锥型的阴离子和一种正四面体型的阳离子。
①[Cu(NH3)4]SO4中Cu2+的电子排布式为?。
②[Cu(NH3)4]SO4中存在的化学键类型有?(填序号)。
A.共价键
B.氢键
C.离子键
D.配位键 E.分子间作用力
③写出与SO42-互为等电子体的一种分子?。上述白色沉淀的化学式为?。
参考答案:
(1)sp3?三角锥型?
(2)①[Ar]3d9?②ACD?(对一个给1分,全对给2分,只要有答案选错,该题得0分)
③SiCl4或SiF4?④Cu(NH4)SO3
本题解析:(1)SCl3+中S原子的价电子对数为(6+3-1)/2=4,所以杂化类型为sp3,有3个配位原子,故空间构型是三角锥型;(2)②[Cu(NH3)4]SO4为配合物,[Cu(NH3)4]2+存在配位键,內界与外界形成离子键,NH3、SO42-存在共价键;③等电子体是原子数和最外层电子总数相同微粒,一般在同一周期左右元素和同族上下找,与SO42-互为等电子体的一种分子SiCl4或SiF4 或CCl4等;④三角锥型的阴离子和一种正四面体型的阳离子只能是SO32-、NH4+,结合沉淀中Cu、S、N的物质的量之比为1:1:1,化学式为Cu(NH4)SO3 。
本题难度:一般