时间:2017-03-02 22:23:09
1、选择题 CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )
A.铊的元素符号为Tl
B.铊原子的质子数为81
C.铊位于第六周期ⅢA族
D.铊的金属性比铝的金属性弱
参考答案:A.由图可知,铊的元素符号为Tl,故A正确;
B.图示中左上角的数字为质子数,则Tl的质子数为81,故B正确;
C.由“6s26p1”表示铊原子有6个电子层,最外层有3个电子.则Tl位于元素周期表中第六周期第ⅢA族,故C正确;
D.同主族从上到下元素的金属性在增强,则铊的金属性比铝的金属性强,故D错误;
故选D.
本题解析:
本题难度:简单
2、选择题 下列关于σ键和π键的理解不正确的是( ? )
A.σ键能单独形成,而π键一定不能单独形成
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.双键中一定有一个σ键、一个π键,三键中一定有一个σ键、两个π键
D.气体单质中一定存在σ键,可能存在π键
参考答案:D
本题解析:
本题难度:简单
3、简答题 有A、B、C、D四种元素,它们均为主族元素,最外层电子数分别为1、4、6、7,原子序数大小为D<B<A<C.又知C元素的一种同位素原子核中有46个中子,它的最高价氧化物的式量与气态氢化物的式量之比值为1.56.
(1)A、B、C、D的元素符号分别是:______
(2)写出A单质与水反应的离子方程式:______
(3)写出D单质与水反应的化学方程式:______
(4)写出A、B的最高价氧化物对应水化物反应的离子方程式:______.
参考答案:(1)A、B、C、D四种元素,它们均为主族元素,最外层电子数分别为1、4、6、7,则应分别为与周期表第ⅠA、ⅣA、ⅥA、ⅦA族,C元素的一种同位素原子核中有46个中子,它的最高价氧化物的式量与气态氢化物的式量之比值为1.56,则C的最高价氧化物CO3,氢化物为H2C,设C元素的质子数为x,则有:(x+46)+3×162+(x+46)=1.56,解之得x=34,则C为Se元素,又原子序数大小为D<B<A<C,则A为K元素,B为Si元素,D为F元素,
故答案为:K、Si、Se、F;
(2)A为K元素,对应的单质K为活泼金属,与水发生剧烈反应生成KOH和H2,反应的离子方程式为2K+2H2O=2K++2OH-+H2↑,
故答案为:2K+2H2O=2K++2OH-+H2↑;
(3)D为F元素,对应的单质与水反应生成HF和O2,反应的化学方程式为2F2+2H2O=4HF+O2↑,
故答案为:2F2+2H2O=4HF+O2↑;
(4)A、B的最高价氧化物对应水化物分别为KOH和H2SiO3,H2SiO3为弱酸,与KOH发生中和反应,反应的离子方程式为2OH-+H2SiO3=SiO32-+2H2O,
故答案为:2OH-+H2SiO3=SiO32-+2H2O.
本题解析:
本题难度:一般
4、选择题 下列化学用语使用正确的是( )
A.NH4H的电子式: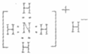
B.丙烷分子的球棍模型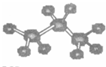
C.次氯酸的结构式:H-Cl-O
D.原子核内有10个中子的氧离子:818O
参考答案:A、NH4H是离子化合物,由铵根离子与氢负离子构成,电子式为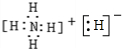
,故A错误;
B、丙烷分子分子式为C3H8,碳原子之间以单键相连,呈锯齿状,碳原子与氢原子之间与单键相连,每个碳原子周围的呈四面体结构,选项中结构与丙烷结构相符合,故B正确;
C、次氯酸中氧原子与氯原子、氢原子之间分别形成1对共用电子对,结构式为H-O-Cl,故C错误;
D、原子核内有10个中子的氧离子,质量数为18,离子符号为818O2-,故D错误.
故选B.
本题解析:
本题难度:一般
5、选择题 氯化钠是人们日常生活中常用的调味品。下列性质中可以证明氯化钠中一定存在离子键的是?
[? ]
A.具有较高的熔点
B.熔融状态能导电
C.水溶液能导电
D.常温下能溶于水
参考答案:B
本题解析:
本题难度:简单