时间:2017-02-07 17:26:52
1、选择题 已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1 Na2SO4溶液,下列叙述正确的是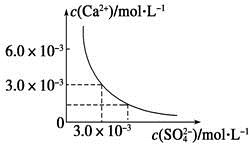
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
2、填空题 (1)某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、?SO32-、SO42-、NO3-和NO2-等。为确定其组成,分别进行下列4组实验
①其中能确认样品中不含SO32-的实验操作是________(填下列实验操作序号);
根据实验结果,你认为是否含有NO2-??________(填“含有”、“不含有”),其原因是________________;
A.取试样,滴加适量的淀粉KI溶液,呈蓝色;
B.取试样,滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
C.取试样,滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
D.取试样,滴加酸性KMnO4溶液,不褪色。
②书写A实验现象的离子方程________________,C?实验说明酸雨中含________________????
(2)某废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的一种处理方法为还原沉淀法。该法的工艺流程为:?? 
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①第①步中若平衡体系的pH=1,该溶液中含Cr元素的微粒是__________________。
②第②步中,还原1molCr2O72-离子,需要__________mol的FeSO4·7H2O。
③第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_____。
Cr3+(aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_____。
3、选择题 下列图示与对应的叙述相符的是( )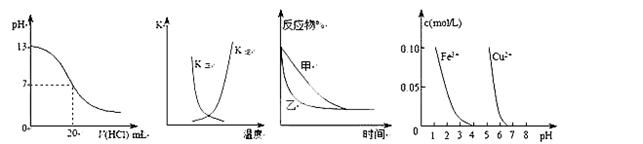
① ② ③ ④
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2A(g) + B(g) 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
C.图③表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。
4、选择题 已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1L0.2mol·L-1HF溶液中加入1L0.2mol·L-1CaCl2溶液,则下列说法中,正确的是
A.25℃时,0.lmol·L-1溶液中pH=l
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaC12反应产生沉淀
5、填空题 (12分)铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O), 为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 请回答下列问题: (1)得到溶液II,需加入氧化剂X, 最适合作氧化剂X的是 。 A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4 (2)加入氧化剂X的目的是 。 (3)为了除去Fe3+,需加入物质Y调节溶液的PH值为 (4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。 (5)已知Fe(OH)3的Ksp=1×10-35mol4/L4;若Fe3+沉淀完全时,在溶液中Fe3+的浓度为1×10-5mol/L, 则此时溶液的PH最小为 . |