时间:2017-02-07 17:20:38
1、简答题 现对0.1mol/L的纯碱溶液进行相关研究.
(1)用pH试纸测定该溶液的pH,其正确的操作______.
(2)由上测得纯碱溶液呈碱性,请用离子方程式表示其原因:______.
(3)某同学根据所学知识对Na2CO3溶液进行分析,写出了以下四个关系式.请你判断:在正确的关系式后面打“√”,在错误的后面写出正确的关系式.
①c(Na+)=2[c(CO32-)+c(HCO3-)]:______;
②c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-):______;
③c(OH-)=c(H+)+c(HCO3-)+c(H2CO3):______;
④c(Na+)>c(CO32-)>c(OH-)>c(HCO3-):______.
参考答案:(1)测定pH的步骤为用玻璃棒蘸取待测液,滴在pH试纸上,颜
本题解析:
本题难度:一般
2、选择题 把0.02 mol·L-1 CH3COOH溶液与0.01 mol·L-1 NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是
[???? ]
参考答案:AD
本题解析:
本题难度:一般
3、填空题 直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示S形成硫酸酸雨的反应方程式______,______.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是______.
(3)吸收液吸收SO2的过程中,pH随n(SO32-),n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 pH 8.2 7.2 6.2 ①上表判断NaHSO3溶液显______性,用化学平衡原理解释:______. ②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):______. a、c(Na+)=2c(SO32-)+c(HSO3-) b、c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-) c、c(Na+)+c(H-)=c(SO32-)+c(HSO3-)+c(OH-) (4)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如图: ①HSO3-在阳极放电的电极反应式是______. ②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:______. 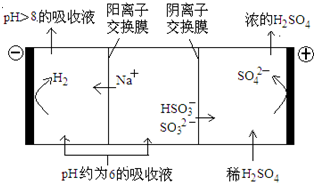 参考答案:(1)二氧化硫是酸性氧化物,和水反应生成亚硫酸,反应方程式为 本题解析: 本题难度:简单 4、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答: 参考答案:(1)若a=7,则HA是强酸,若a>7,则HA是弱酸< 本题解析: 本题难度:一般 5、选择题 已知可发生反应:2Fe2+ +Br2 ==2Fe3+ +2Br-,2Fe3++2I- ==2Fe2+ +I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。则下列有关说法中正确的是 参考答案:B 本题解析: 本题难度:一般 |