时间:2017-02-07 16:54:50
1、选择题 设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.1 mol硫酸钾中阴离子所带电荷数为NA
B.乙烯(C2H4)和环丙烷(C3H6)组成的28 g混合气体中含有2NA个氢原子
C.1mol Na2O2固体中含有NA个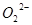
D.将含0.1 mol氯化铁的饱和溶液滴加到沸水中可制取0.1NA个 Fe(OH)3胶体微粒
参考答案:C
本题解析:考查阿伏加德罗常数的应用。1 mol硫酸钾中阴离子所带电荷数为2NA,选项A不正确;乙烯(C2H4)和环丙烷(C3H6)的最简式相同,都是CH2,所以28 g混合气体中含有4NA个氢原子,选项B不正确;氯化铁与水反应制取胶体的反应是可逆的,选项D不正确,答案选C。
本题难度:一般
2、选择题 当0.01mol氯化铬(Ⅲ)(CrCl3·6H2O)在水溶液中用过量的硝酸银处理时,有0.02mol氯化银沉淀析出,此样品的配离子的表示式为(????)
A.[Cr(H2O)6]3+
B.[CrCl(H2O)5]2+
C.[CrCl2(H2O)4]+
D.[CrCl3(H2O)3]
参考答案:B
本题解析:
试题分析:根据0.01mol CrCl3·6H2O中有0.03molCl,沉淀了0.02molCl,说明配离子中含有0.01molCl,则选B。
点评:排除法是选择题中比较快速的解题方法。
本题难度:一般
3、选择题 标准状况下的1.5molH2的体积约为( )
A.11.2L
B.22.4L
C.33.6L
D.44.8L
参考答案:标准状况下的1.5molH2的体积为1.5mol×22.4L
本题解析:
本题难度:简单
4、选择题 将一定质量的镁和铝的混合物投入100ml盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列说法正确的是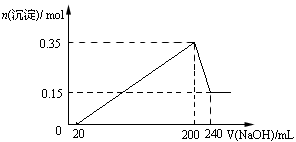
A.镁和铝的总质量为9g
B.盐酸的物质的量浓度为5 mol·L-1
C.NaOH溶液的物质的量浓度为5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
参考答案:AC
本题解析:
试题分析:根据图像可知,加入氢氧化钠溶液后并没有立即生成沉淀,这说明稀硫酸是过量的,所以应该有关的方程式是H++OH-=H2O、Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓、Al(OH)3+OH-=AlO2-+2H2O。根据图像可知,和氢氧化铝反应的氢氧化钠溶液是240ml-200ml=40ml,则氢氧化铝的物质的量是0.35mol-0.15mol=0.20mol,氢氧化镁是0.15mol,所以根据原子守恒可知,镁和铝的总的质量是0.15mol×24g/mol+0.2
本题难度:一般
5、选择题 0.5L 1mol/L FeCl3溶液与0.2L 1mol/LKCl溶液中的C(Cl-)之比是
A.5 :2
B.15 :2
C.3 :1
D.1 :3
参考答案:C
本题解析:略
本题难度:一般