时间:2017-02-07 16:53:11
1、选择题 下列说法中正确的是(NA为阿伏加德罗常数)????????(???)
A.78 gNa2O2晶体中所含阴阳离子个数均为2NA
B.1.5 g CH3+中含有的电子数为NA
C.3.4 g氨气分子中含有0.6NA个N—H键
D.常温下,100 mL1 mol·L-1AlCl3溶液中Al3+离子总数等于0.1NA
参考答案:C
本题解析:A错,Na2O2晶体是由Na+、O22—离子构成,阳离子与阴离子个数比为2:1,78 gNa2O2晶体中所含阳离子个数均为2NA,阴离子个数为NA;B错,1.5 g CH3+中含有的电子数为0.8NA;
C正确,.3.4 g氨气分子中含有0.6NA个N—H键;D错,常温下,100 mL1 mol·L-1AlCl3溶液中Al3+离子总数小于0.1NA
本题难度:一般
2、选择题 将0.8g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是 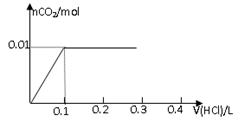
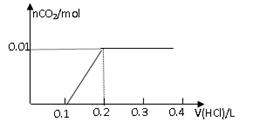
A B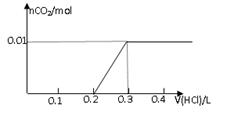
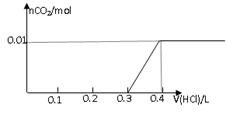
C D
参考答案:D
本题解析:
试题分析:对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钠与盐酸的中和反应,再发生碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠,最后发生碳酸氢钠与盐酸反应才有二氧化碳气体生成,有关反应的方程式分别是NaOH+HCl=NaCl+H2O、HCl+Na2CO3=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。0.8g NaOH和1.06g Na2CO3物质的量分别是0.8g÷40g/mol=0.02mol、1.06g÷106/mol=0.01mol,三步反应中消耗氯化氢的物质的量分别是0.02mol、0.01mol和0.01mol,对应盐酸的体积是0.2L、0.1L、0.1L,即盐酸的体积滴加到0.3L时开始出现气体,滴加到0.4L时气体达到最大值,因此选项D符合,答案选D。
考点:考查盐酸与氢氧化钠和碳酸钠混合液反应的计算以及图像识别等
点评:该题时高考中的常见题型,属于中等难度的试题,主要是考查了元素化合物、图象数据的处理知识。试题贴近高考,难易适中,有利于培养学生的逻辑推理能力和创新思维能力。解答此题的易错点是,不能准确理解向碳酸钠溶液中滴加盐酸的反应.是分步进行的,首先发生的是HCl+Na2CO3=NaHCO3+NaCl;进行完全后,再发生:NaHCO3+HCl=NaCl+H2O+CO2↑。
本题难度:一般
3、选择题 NA为阿伏加德罗常数,下列叙述正确的是
A.1L 0.5mol·L-1氨水中所含NH4+数为0.5NA
B.1mol Fe与足量氯气反应转移的电子数为2 NA
C.标准状况下,33.6L CO2约含有1.5NA个分子
D.1 mol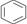 中含碳碳双键数为3 NA
中含碳碳双键数为3 NA
参考答案:C
本题解析:
试题分析:A.氨水中的一水合氨是弱碱,部分电离,所以1L 0.5mol·L-1氨水中所含NH4+数小于0.5NA,错误;B.由于氯气的氧化性强,可以把变价金属Fe氧化为高价态,所以1mol Fe与足量氯气反应转移的电子数为3NA,错误;C.标准状况下,33.6L CO2的物质的量是1.5mol,因此约含有1.5NA个分子,正确;D.苯的分子结构中无碳碳双键,错误。
考点:考查阿伏加德罗常数的计算的知识。
本题难度:一般
4、实验题 (9分)实验室用氯化钠固体配制100mL 1.0 mol·L-1的NaCl溶液,有如下操作步骤:
①用托盘天平称量____________g NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
②继续向容量瓶中加蒸馏水至液面距刻度线1-2cm处,改用_____________小心滴加蒸馏水至溶液凹液面的最低处与刻度线相切;
③把①中所得溶液小心地转入______________________中;
④将容量瓶塞紧,充分摇匀;
⑤用少量蒸馏水洗涤烧杯与玻璃棒2-3次,洗涤液一并转移到容量瓶中。
(1)将上述步骤的空白处填空;
(2)本实验操作步骤的正确顺序是(填序号,不能重复) ;
(3)试分析下列操作对所配得溶液的浓度有何影响(填:“偏高”、“偏低”、
或“无影响”)
①容量瓶用蒸馏水洗净后没有干燥就直接用来配溶液,所配得溶液的浓度 ;
②定容时,仰视刻度线,所配得溶液的浓度 ;
③定容后,加盖倒转摇匀后,发现液面低于刻度线,所配得溶液的浓度 。
参考答案:(1) 5.9 (2分) ;胶头滴管;
本题解析:
试题分析:(1)100mL 1.0 mol·L-1的NaCl溶液中氯化钠的质量是0.1L×1.0mol/L×58.5g/mol=5.85g,由于托盘天平的只能读数到0.1g,所以需要称量2.9g氯化钠;定容时需要胶头滴管;配制100ml溶液,则就需要100ml容量瓶。
(2)根据配制原理和要求可知,正确的操作顺序是①③⑤②④。
(3)根据c=n/V可知,如果容量瓶洗净后直接配制,则对结果是无影响的;如果定容时,仰视刻度线,则容量瓶中溶液的体积偏多,所以所配得溶液的浓度偏低;定容后,加盖倒转摇匀后,发现液面低于刻度线,属于正常现象,无影响。
考点:考查物质的量浓度溶液的配制、仪器的选择、误差分析等
点评:根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。
本题难度:一般
5、填空题 (4分)0.2molO3和0.3molO2的质量 (选填“相等”、“不相等”或“无法判断”),分子数之比为 ,所含原子数之比为 ,在相同条件下的体积之比为 。
参考答案:相等、2:3 、 1:1 &
本题解析:略
本题难度:一般