时间:2017-02-07 16:32:23
1、选择题 实验室中需要配制2mol·L-1的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是[???? ]
A.950mL,111.2g
B.500mL,117g
C.1000mL,117g
D.任意规格,111.2g
参考答案:C
本题解析:
本题难度:简单
2、简答题 (1)要配制浓度约为2mol/L?NaOH溶液100mL,下列操作正确的是(填代号)______.
A、称量8g?NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯
中,同时不断搅拌至固体溶解
B、称量8g?NaOH固体,放入100mL量筒中,边搅拌边加蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C、称量8g?NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加蒸馏水至刻度,盖好瓶塞,反复摇匀.
D、用100mL量筒量取40mL?5mol/L?NaOH溶液,倒入250mL烧杯中,再用同一量筒量取60mL蒸馏水,再慢慢搅拌下慢慢倒入烧杯中
(2)要配制500mL?0.200mol/L的H2SO4溶液,需要的仪器有量筒、烧杯、______.需要98%的浓硫酸(密度1.84g/mL)______mL.下列操作会使所配的溶液浓度偏小的是(填代号)______.
A、用量筒量取一定体积的98%的浓硫酸,稀释后未经冷却即转入容量瓶内;
B、稀释硫酸所用的小烧杯未洗涤???
C、定容时仰视观察液面
D、定容时俯视观察液面???????????
E、用蒸馏水洗涤后的容量瓶未干燥
F、定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液溅出瓶外.
参考答案:(1)溶质的质量为m=nM=cvM=2mol/L×0.1L×
本题解析:
本题难度:一般
3、选择题 配制240mL1mol/LNaOH溶液,需进行下列操作:①在干燥洁净的滤纸上准确称量9.6g固体氢氧化钠,并转入洗净的烧杯中;②往烧杯中加入约60mL蒸馏水,用玻璃棒搅拌使之完全溶解;③立即将烧杯中的溶液沿玻璃棒注入250mL容量瓶中;④倒完烧杯中的溶液后,再小心加蒸馏水至液面接近刻度线1~2cm处;⑤改用胶头滴管滴加蒸馏水,使溶液凹液面最低处恰好与刻度线相切;⑥塞紧瓶塞,振荡均匀,静置,此时凹液面低于刻度线,再滴加蒸馏水至刻度线.其中操作正确的是( )
A.①②③⑤
B.②③④⑤
C.①②④⑤⑥
D.②⑤
参考答案:实验室没有240mL容量瓶,实际上配制的溶液为250mL1m
本题解析:
本题难度:简单
4、选择题 将物质的量均为a?mol的钠和铝一同投入m?g水中(水足量),所得溶液的密度为ρg?Cm-3,则此溶液的物质的量浓度为
A.mol/L
B.mol/L
C.mol/L
D.mol/L
参考答案:C
本题解析:分析:将物质的量均为a?mol的钠和铝投入足量水中发生反应:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由方程式可知,溶液为偏铝酸钠溶液,偏铝酸钠的物质的量为amol.根据方程式计算生成氢气的物质的量,在计算氢气质量,溶液质量为m(溶液)=m(金属)+m(H2O)-m(H2),据此计算溶液质量,利用V=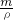 计算溶液体积,再利用c=
计算溶液体积,再利用c=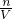 计算溶液物质的量浓度.
计算溶液物质的量浓度.
解答:钠和铝投入足量水中发生反应:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
由方程式可知,a?mol的钠反应生成amol氢氧化钠,生成氢气0.5amol;amol氢氧化钠与amol铝恰好反应生成amol偏铝酸钠,同时生成氢气1.5amol.溶液为偏铝酸钠溶液.
所以氢气的质量为(0.5amol+1.5amol)×2g/mol=4ag;
所以溶液质量m(溶液)=m(金属)+m(H2O)-m(H2)=amol×23g/mol+amol×27g/mol+mg-4ag=(46a+m)g,
所以溶液的体积为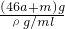 =
=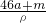 ml
ml
所以溶液的物质的量浓度为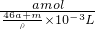 =
=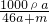 mol/L.
mol/L.
故选:C.
点评:考查物质的量浓度的计算,难度中等,判断溶液是偏铝酸钠是解题关键,然后利用物质的量浓度定义式计算.理解物质的量浓度的概念.
本题难度:一般
5、选择题 配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是
[???? ]
参考答案:C
本题解析:
本题难度:一般