时间:2017-02-07 15:57:04
1、选择题 利用反应:2NO(g)+2CO(g)
2CO2(g)+N2(g)△H=-746.8kJ?mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
A.降低温度
B.及时将CO2和N2从反应体系中移走
C.升高温度同时充入N2
D.增大压强同时加催化剂
2、选择题 在恒温时,一固定容积的容器内发生如下反应:2NO2(g)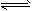 N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
[???? ]
3、填空题 研究NO2、SO2?、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________________________。利用反应6NO2+?8NH3 7N2+12H2O也可处理NO2。当转移12mol电子时,消耗的NO2在标准状况下是_________L。
7N2+12H2O也可处理NO2。当转移12mol电子时,消耗的NO2在标准状况下是_________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g)?ΔH=-196.6?kJ/mol
2SO3(g)?ΔH=-196.6?kJ/mol
2NO(g)+O2(g) 2NO2(g)?ΔH=-113.0?kJ/mol?????????
2NO2(g)?ΔH=-113.0?kJ/mol?????????
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=____________kJ/mol。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。
SO3(g)+NO(g)的ΔH=____________kJ/mol。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。
a.体系平均摩尔质量不变???????
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变?????
d.每消耗1?mol?SO3的同时生成1?molNO2?
e.体系压强保持不变????
f.每生成1?mol?SO2的同时消耗1?molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=___________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“?<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“?<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________。 
4、填空题 苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)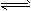 C6H5CH=CH2(g)+
C6H5CH=CH2(g)+
H2(g) △H=+125kJ/mol
(1)该反应的平衡常数表达式为K=_______。随着温度的升高,K值________(填“增大”“减小”或“不变”)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。 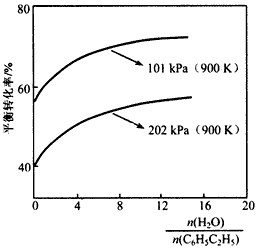
①由上图可得出:
结论一:其他条件不变,水蒸气的用量越大,平衡转化率越____;
结论二:____________。
②加入稀释剂能影响C6H5C2H5平衡转化率的原因是:__________________。
(3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高C6H5C2H5的平衡转化率。试解释其原因:____________________。
5、填空题 反应①Fe(s) +CO2(g)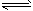 FeO(s) +CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s) +CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)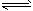 FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表
FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表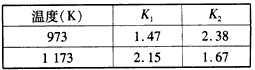
(1)写出反应①的平衡常数表达式:K1=_________,推导反应CO2(g)+H2(g)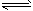 CO(g)+H2O(g)的平衡常数K与K1、K2的关系式_________。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式_________。
(2)在恒压容器中,加入一定量的CO2和H2,在温度为1173 K时达到化学平衡,若向容器中加入Ar,则达到新平衡时,平衡常数K__________(填“增大”、“减小”或 “不变”),此时CO2浓度与原平衡时的浓度相比,会________(填“增大”、“减小”或“不变”)。
(3)已知
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ/mol ①
2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ/mol ②
则反应CO2(g)+H2(g) CO(g)+H2O(g)的△H=__________。
CO(g)+H2O(g)的△H=__________。