时间:2017-02-07 15:47:04
1、选择题 下列有关实验的操作、现象和原理,正确的是
①吸滤操作可加快过滤速度,若吸滤完毕,则应先关闭水龙头,然后拆下连接抽气泵和吸滤瓶的橡皮管;②往海带灰的浸泡液中加入过量的氯水,以保证I-完全氧化为I2;③重结晶时,溶液冷却速度越慢得到的晶体颗粒越大;④可用水鉴别已烷、四氯化碳、乙醇三种无色液体;⑤油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离;⑥加酶洗衣粉可用来洗涤棉织品、腈纶织品和涤纶织品;⑦硫酸亚铁铵晶体制备实验的最后一步是将溶液蒸发到有大量晶体析出,用余热蒸干即可得产物;⑧萃取时振荡的操作如图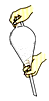
A.②④⑧
B.①③⑤
C.③④⑥
D.②④⑦
2、选择题 直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH) n (SO4) 3-n/2]m (n>2 , m≤10)的实验流程如下:
已知:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%。
(1)实验加入硫酸的作用是???。取样分析Fe2+浓度,其目的是???。
(2)用pH试纸测定溶液pH的操作方法为???。若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数???。(填“偏高”、“偏低”、“无影响”)
(3)氧化时控制反应温度为50~60℃的原因是???。
(4)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]  ?[Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为???。
?[Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为???。
(5)产品盐基度的测定方法:
Ⅰ 称取m g固体试样,置于400 mL聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。
Ⅱ 室温下放置10 min,再加入10 mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀。
Ⅲ 加入5滴酚酞指示剂,立即用物质的量浓度为c mol·L-1的氢氧化钠标准液滴定至终点,消耗体积为V?ml。
Ⅳ 向聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0 ?ml。
①达到滴定终点的现象为???。
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为???。
3、选择题 下列实验操作,能达到预期目的的是?
①用托盘天平称取5.6gCuO粉末②用10mL水和10mL酒精配制成20mL酒精溶
液③用10mL量筒量取8.2mL水④将50g溶质质量分数为10%的稀盐酸加热蒸发掉
25g,得到溶质质量分数为20%的盐酸?????????????????????????
A.①③
B.②③
C.①②③
D.①③④
4、实验题 (13分)
(1)某化学实验小组从市场上买来一瓶食用白醋(含CH3COOH),用实验室标准NaOH溶液对其进行滴定以测定醋酸浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂 的变色范围:
的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 | ||||||||||
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 ①该实验应选用?????????????作指示剂。 ②下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为??????????mL; 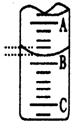 ③为减小实验误差,该同学一共进行了三次实验,假设每 次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验 结果记录如下: 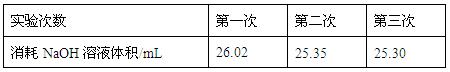 从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是???????。 A.实验  结束时,俯视刻度线读取滴定终点时NaOH溶液的体积 结束时,俯视刻度线读取滴定终点时NaOH溶液的体积B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液 C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗 D.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定 (2)乙二酸俗  名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。查阅资料得知,草酸易溶于水,有还原性,可以用酸性KMnO4溶液进行滴定: 名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。查阅资料得知,草酸易溶于水,有还原性,可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+ 该组同学设计了滴定的方法测定x值。 称取1.260 g纯草酸晶体,配制成100.00 mL水溶液为待测液; 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4; 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL; 请回答: ①  滴定时,将KMnO4标准液装在下图中的?????(填“甲”或“乙”)滴定管中。 滴定时,将KMnO4标准液装在下图中的?????(填“甲”或“乙”)滴定管中。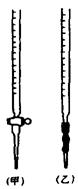 ②本实验滴定达到终点的标志是?????????????????????????????????????????????? ③通过上述数据,计算出x=????????????? 5、实验题 某同学进行实验研究时,欲配1.0mol?L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在足量的水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
|