时间:2017-02-07 15:39:05
1、选择题 下列溶液中微粒的物质的量浓度关系正确的是(??)
A.Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H+)
B.等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+)=c(X-)>c(OH-)=c(H+)
C.常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:
c(Cl-)>c(NH4+)> c(NH3·H2O)>c(OH-)>c(H+)
D.将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:
c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
参考答案:D
本题解析:
试题分析:A不正确,应该是c(ClO-)>c(Ca2+)>c(OH-)>c(H+);B不正确,因为溶液不一定呈中性;C不正确,因为氨水过量,溶液显碱性,即氨水的电离程度大于氯化铵的水解程度,所以应该是c(NH4+)>c(Cl-)> c(NH3·H2O)>c(OH-)>c(H+);根据电荷守恒和物料守恒可知,D正确,答案选D。
点评:在比较溶液中离子浓度大小时,应该注意利用几个守恒,即电荷守恒、物料守恒和质子守恒。
本题难度:一般
2、填空题 水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如下图所示: 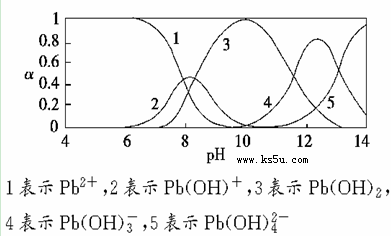
(1)Pb(NO3)2溶液中,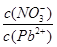 ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,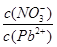 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有__________,pH=9时主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg·L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg·L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是________。 (4)如果该脱铅剂(用EH表示)脱铅过要发生的反应程中主为:2EH(s)+Pb2+  E2Pb(s)+2H+则脱铅的最合适pH范围为(??? ) E2Pb(s)+2H+则脱铅的最合适pH范围为(??? )A.4~5???? B.6~7 ????C.9~10???? D.11~12 参考答案:(1)>??Pb2+与Cl-反应,Pb2+浓度减少 本题解析: 3、选择题 已知某溶液中存在 参考答案:C 本题解析:该溶液是氯化铵溶液,其水解显酸性. 本题难度:一般 4、选择题 向三份均为100mL0.5mol·L-1NaHCO3溶液中,分别加入少量冰醋酸、Ca(OH)2固体、NaAlO2固体(忽略溶液体积变化),则三份溶液中c(CO32-)的变化依次为 参考答案:B 本题解析: 本题难度:简单 5、选择题 20℃时,两种一元弱酸的钠盐NaX和NaY,已知,往NaX溶液中 参考答案:B 本题解析:略 本题难度:一般 |