时间:2017-02-07 15:31:10
1、填空题 有下列几种晶体,完成下列各小题。
A干冰;B氯化钠;C冰;D水晶;E氯化铵;F晶体氖;G铝;HC60;I金刚石
(1)属于分子晶体的是????????????????,属于离子晶体的是???????????????。
(2)晶体中有氢键的是?????????????????,受热熔化只需克服共价键的是________。
参考答案:(1)ACFH(2分)??? BE(2分)????(2) C
本题解析:
试题分析:(1)分子晶体的构成微粒为分子,但稀有气体形成的分子晶体由原子构成的分子;其中 A C F H为分子晶体;原子晶体的构成微粒为原子;离子晶体的构成微粒为阴阳离子;其中 B E为离子晶体。
(2)晶体中有氢键常见有HF、H2O、NH3、含羟基的某些有机物如醇类(乙醇、甘油等,一般碳原子数比较少,多了影响相对比较小)、羟基酸等。热融化只需要克服共价键的有 D I 。
本题难度:一般
2、选择题 下列MgCl2的电子式中,正确的是[???? ]
A.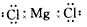
B.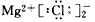
C.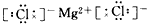
D.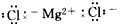
参考答案:C
本题解析:
本题难度:简单
3、填空题 物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_________________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO_____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的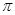 键有________mol。
键有________mol。
参考答案:(8分)(1)1s22s22p63s23p63d84s2(2
本题解析:
试题分析:(1)Ni的原子序数为28,根据构造原理和能量最低原理可写出电子排布式为1s22s22p63s23p63d84s2。第二周期有2个未成对电子的元素是C和O元素,非金属性越强,电负性越大。碳元素的非金属性弱于氧元素,因此电负性较小的是C元素。
(2)Ni2+和Fe2+的离子半径分别为69pm和78pm,离子半径越小,离子键作用力越大,晶体的熔沸点越高,所以熔点NiO>FeO。NaCl中钠离子和氯离子的配位数分别为6,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别
本题难度:一般
4、填空题 下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题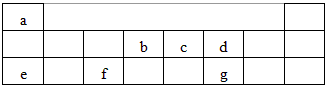
(1)f元素在周期表中的位置是第_______周期第________族。
(2)e与f两元素最高价氧化物的水化物相互反应的化学方程式为___________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4)化合物ca3的电子式为____________,c和d两种元素氢化物的稳定性更强的是_______(填物质的化学式)。
参考答案:(1)3;IIIA?
(2)NaOH+Al(OH)3=
本题解析:
本题难度:一般
5、选择题 美国科学家设想“绿化”火星并使其成为第二个地球:火星上造超级温室气体.美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划.有关全氟丙烷的说法正确的是( )
A.分子中三个碳原子可能处于同一直线上
B.全氟丙烷的电子式为:
C.相同压强下,沸点:C3F8<C3H8
D.全氟丙烷中及既有极性键又有非极性键
参考答案:D
本题解析:
本题难度:简单