时间:2017-02-07 15:30:11
1、选择题 右图是向MgCl2、AlCl3混合溶液中,开始滴加7ml试剂A,之后改滴试剂B,所得沉淀ymol 与试剂体积V(ml)间的关系.以下结论不正确的是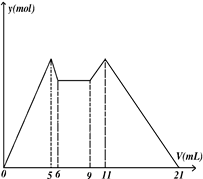
A.横坐标从5到6溶液中Al3+浓度在上升
B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl—)=1∶1∶5
C.A是NaOH,B是盐酸,且c(NaOH)∶c(HCl)=2∶1
D.横坐标从6到9,相应离子反应式H++OH— =H2O
参考答案:A
本题解析:
试题分析:向MgCl2、AlCl3混合溶液中,开始滴加7ml试剂A,之后改滴试剂B。
横坐标从5到6溶液中,是生成的氢氧化铝转化为偏铝酸钠的过程,所以溶液中根本就不存在Al3+,所以也就无所谓下降和上升。错误,故选A.向MgCl2、AlCl3混合溶液中,开始滴加7ml试剂A,之后改滴试剂B。可以从图像上看到,镁离子和铝离子先转化为沉淀,而后沉淀又消失,说明,A是NaOH,B是盐酸,从量的关系可以看到:从0-5沉淀达到最大值,从11-21沉淀完全消失,所以浓度存在以下关系:c(NaOH)∶c(
本题难度:简单
2、填空题 铝灰的回收利用方法很多,现用含有Al2O3,SiO2和少量FeO xFe2O3的铝灰制备Al2(S04)3
xFe2O3的铝灰制备Al2(S04)3 18H2O,工艺流程如下:
18H2O,工艺流程如下: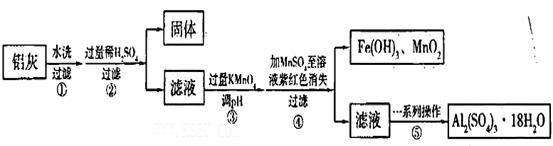
请回答下列问题:
(1)加入过量稀H2SO4溶解Al2O3的离子方程式是______________。
(2)流程中加人的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为_______________。
(3)已知:浓度均为O.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如下表: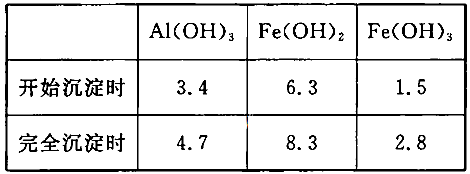
步骤③的目的是__________________________________________________________;若在该浓度下除去铁的化合物,调节pH的最大范围是___________。
(4)已知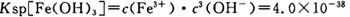 当pH=2时,Fe3+开始沉淀的浓度为_______________。
当pH=2时,Fe3+开始沉淀的浓度为_______________。
(5)操作④发生反应的离子方程式为__________________________________________;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是_________或_________。
(6)操作⑤“一系列操作",下列仪器中不需用的是___________(填序号)。
A.蒸发皿
B.坩埚
C.玻璃棒
D.酒精灯E.漏斗
参考答案:(1)6H+ + Al2O3=2Al3+ + 3H2O (2
本题解析:
试题分析:(1)加入过量稀H2SO4溶解Al2O3的离子方程式是6H+ + Al2O3=2Al3+ + 3H2O 。(2)流程中加人的KMnO4也可用H2O2代替,H2O2有强氧化性把二价铁离子氧化为三价铁离子,发生反应的化学方程式为H2O2 + 2FeSO4 + H2SO4 =" Fe2(SO4)3" + 2H2O 。(3)根据流程图可知是将二价铁离子氧化三价铁离子,并通过调节PH值把三价铁离子转化为氢氧化铁沉淀除去,确保铝离子不要沉淀出来,故调节pH范围为:2.8到3.4。(4)已知
本题难度:一般
3、选择题 现代建筑的门框架常用电解加工成古铜色的硬铝制造,硬铝是(???)
A.AlSi合金
B.AlCuMnSi合金
C.AlMg合金
D.表面有氧化铝膜的纯铝
参考答案:B
本题解析:根据教材等资料可以很容易查到硬铝是Al、Cu、Mn、Si四种元素合金。
本题难度:一般
4、选择题 欲使明矾溶液中的Al3+完全沉淀下来,适宜的试剂是:
A.NaOH溶液
B.盐酸
C.氨水
D.氯化钡溶液
参考答案:C
本题解析:本题能力层次为B,Al(OH)3是两性氢氧化物,能溶于酸和强碱溶液,用NaOH溶液和Al3+反应时,NaOH少量或过量都不能完全沉淀。答案是C;
学法指导:学习铝及其重要化合物的性质,重点把握“三价、两性、氧化膜”。 Al2O3、Al(OH)3呈两性,但它们不溶于弱碱溶液(如氨水)。制备Al(OH)3时,可用铝盐溶液和氨水反应。
本题难度:简单
5、选择题 两份等质量的铝片分别与足量的盐酸和足量的氢氧化钠溶液反应,产生的气体在同条件下的体积比为????????????????????
A.1∶1
B.3∶2
C.2∶3
D.1∶6
参考答案:A
本题解析:
由方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,2Al+6HCl=2AlCl3+3H2↑可知,铝不论是和酸产生氢气,还是和碱反应产生氢气,都是失去3个电子的,因此生成的氢气相等,答案选A。
本题难度:一般