时间:2017-02-07 15:30:11
1、选择题 (原创题)某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。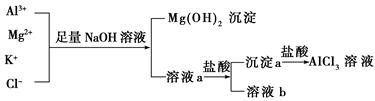
下列说法正确的是( )
A.NaOH溶液可以用氨水来代替
B.溶液a只含有Al3+、K+、Cl-、Na+、OH-
C.溶液b中只含有NaCl
D.向溶液a中滴加盐酸需控制溶液的pH
参考答案:D
本题解析:A项用氨水将会使Al3+、Mg2+均沉淀下来,达不到分离的目的;B项a中不再含有Al3+,转化为AlO2—;C项b中含有KCl、NaCl、HCl等物质;D项若不控制pH,沉淀Al(OH)3将不能分离出来。
本题难度:一般
2、选择题 相同质量的两份铝粉,分别跟足量的稀H2SO4和NaOH溶液反应,生成的气体体积之比为( )
A.3:2
B.3:1
C.1:1
D.1:3
参考答案:根据金属铝跟足量的稀H2SO4和NaOH溶液反应原理2Al+
本题解析:
本题难度:一般
3、填空题 日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下。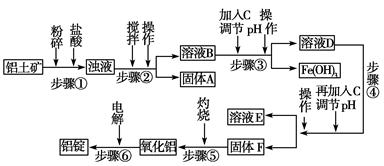
一些氢氧化物沉淀的pH如下表。
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5mol/L) | 5.2 | 4.1 | 12.4 ? 请回答下列问题。 (1)实验室进行步骤④的操作名称为________。 (2)固体A的化学式为________,物质C的化学式为________。 (3)步骤④调节pH的范围为________。 (4)步骤⑥反应的化学方程式为________。 参考答案:(1)过滤 本题解析:本题以工业生产铝锭的工艺流程为背景,考查内容包括pH的选择、过滤操作、常见金属元素及其化合物的主要性质等。SiO2是酸性氧化物不与盐酸反应,进行过滤操作(步骤②),得到固体A是SiO2;加入NaOH溶液,调节pH使Fe3+沉淀,步骤④是过滤得到氢氧化铝沉淀。步骤④为使Al3+完全沉淀,而Mg2+不能产生沉淀,需调节溶液的pH在5.2~10.4之间。 本题难度:一般 4、计算题 (4分)NaOH、MgCl2、AlCl3的混合物溶于H2O后,加入0.5mol/L的稀盐酸溶液,变化如图,求: 参考答案:(2分/空,共4分) (1) 2.6 g??(2)130 m 本题解析:略 本题难度:简单 5、计算题 向含有0.2moI AICI3的溶液中加入了一定量的1moI/L的NaOH溶液后,生成了7.8克沉淀,则加入的NaOH溶液的体积是多少mL?(共8分) 参考答案:解:分两种情况 本题解析:略 本题难度:一般 |