时间:2017-02-07 15:28:51
1、填空题 (11分)、现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸中,A上有气泡;②把C、D用导线连接后同时浸入稀硫酸中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C。装置如图所示,根据上述情况,回答下列问题: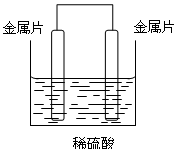
(1)四种金属的活动性顺序是_________________。
(2)在①中,金属片_____作负极;在②中,金属片_____上有气泡产生;在③中,金属片_____发生氧化反应。
(3)如果把B、D用导线连接后同时浸入稀硫酸中,则金属片_____上有气泡产生,该电极反应式为____________________。
(4)图示装置(金属片取①~③中的任一组)称为_________,它利用氧化还原反应将______能转化为______能。
参考答案:(1)B>A>C>D(2分)??(2)B;
本题解析:原电池中较活泼的金属作负极,失去电子,发生氧化反应,电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。所以根据①~③可知金属性强弱顺序为B>A>C>D。因此在①中B是负极,②中D是正极,所以D电极生成氢气。③中A是负极,发生氧化还原反应。由于B的金属性强于D的,所以BD构成原电池时B是负极,D是正极,氢离子放电,电极反应式为2H+ + 2e = H2↑。
本题难度:一般
2、实验题 (8分)某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为?????????????????????????????????????????。
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。
正极反应式:????????????????????????????????;负极反应式:?????????????????????????????。
若该电池中有0.1mol的电子转移,请问消耗?????????????克Fe
方案Ⅲ.结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同): __________________,用离子方程式表示其反应原理:______________
参考答案:(共8分)
方案Ⅰ:Fe+2H+=Fe2++H2↑(1
本题解析:金属的活动性有多种验证方法。例如与水和酸置换氢气的能力;最高价氧化物水化物的碱性强弱;原电池原理;电解原理的应用、金属之间的置换等等。
本题难度:一般
3、选择题 如图各装置中,溶液均为稀硫酸,不能构成原电池的是( )
A.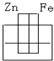
B.
C.
D.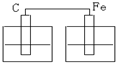
参考答案:前三个装置均符合原电池的构成条件:活泼性不同的两个电极、电解
本题解析:
本题难度:一般
4、选择题 原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是
A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、NaCl溶液组成原电池,其负极反应式为:Cu - 2e-= Cu2+
D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗Cu电极32g
参考答案:C
本题解析:
试题分析:A.由Al、Cu、稀H2SO4组成原电池,Al作负极,Cu作正极,根据同种电荷相互排斥,异种电荷相互吸引,所以放电时SO42-向正电荷较多的负极Al电极移动,正确;B.由Mg、Al、NaOH溶液组成原电池,Al作负极。其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O,正确;C.由Fe、Cu、NaCl溶液组成原电池,发生吸氧腐蚀,Fe活动性比Cu强,作负极,Cu作正极,其负极反应式为:Fe-2e-=Fe2+,错误;D.由Al、Cu、浓硝酸组成原电池,由于Al在浓硝酸中会发生钝化,所以Cu作负极,Al作正极,该原电池作电源,用石墨电极来电解硝酸银溶液,因为在整个闭合回路中电子转移数目相等。当析出1 mol Ag时,电子转移1mol,则消耗的Cu的质量为32 g,正确,选C。
考点:考查原电池的工作原理。
本题难度:困难
5、填空题 甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题: 
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的 棒;乙池中的 棒。
②在乙池中阳极的电极反应式是 。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式 。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则溶液混匀后的pH= 。
参考答案:(1)① 碳(C );铁(Fe) (2分) ② 4
本题解析:
本题难度:一般